Portal adrreports.eu umożliwia publiczny dostęp do zgłoszeń podejrzewanych działań niepożądanych zarejestrowanych w systemie EudraVigilance przez krajowe organy ds. rejestracji leków oraz firmy farmaceutyczne posiadające pozwolenie na dopuszczenie leków do obrotu w państwach należących do Europejskiego Obszaru Gospodarczego (EOG).
Europejska Agencja Leków (EMA) pełni istotną funkcję w procesie monitorowania bezpieczeństwa leków na terenie Unii Europejskiej, który określany jest jako nadzór nad bezpieczeństwem farmakoterapii. Głównym zadaniem Agencji w tej dziedzinie jest koordynacja europejskiego systemu nadzoru nad bezpieczeństwem farmakoterapii oraz poradnictwo dotyczące bezpiecznego i skutecznego stosowania leków. W ramach tych obowiązków Agencja odpowiada za opracowanie, prowadzenie na bieżąco i koordynację systemu EudraVigilance służącego do zgłaszania przypadków podejrzewanych działań niepożądanych leków.
Dane są przekazywane do systemu EudraVigilance w formie elektronicznej przez krajowe organy ds. rejestracji leków oraz firmy farmaceutyczne posiadające pozwolenie na dopuszczenie leków do obrotu. Dane z systemu EudraVigilance są publikowane w 26 językach w europejskiej bazie danych zgłoszeń podejrzewanych niepożądanych działań leków na portalu adrreports.eu. Portal ten umożliwia także użytkownikom podgląd łącznej liczby przekazanych do systemu EudraVigilance zgłoszeń indywidualnych podejrzewanych działań niepożądanych (zwanych także zgłoszeniami pojedynczych przypadków zagrożenia bezpieczeństwa [ICSR]) leków dopuszczonych do obrotu w państwach EOG. EMA publikuje dane dostępne na portalu adrreports.eu, tak by interesariusze, włącznie z ogółem społeczeństwa, mogli mieć dostęp do informacji, z których mogą korzystać europejskie organy ds. rejestracji w celu analizy bezpieczeństwa stosowania leku lub substancji czynnej.
Dane dostępne na tym portalu opierają się na spontanicznych zgłoszeniach działań niepożądanych przekazanych przez pacjentów, przedstawicieli fachowego personelu medycznego lub pochodzących z innych źródeł, które następnie wprowadzane są w formie elektronicznej do systemu EudraVigilance jako ICSR przez krajowe organy ds. rejestracji leków oraz firmy farmaceutyczne.
Przed przekazaniem ICSR do systemu EudraVigilance osoba zgłaszająca wprowadza stosowne elementy danych i podaje informacje dotyczące podejrzewanego działania niepożądanego/podejrzewanych działań niepożądanych (znanych też jako objawy niepożądane lub reakcje niepożądane) obserwowanych po zastosowaniu jednego lub większej liczby leków. Te podejrzewane działania niepożądane niekoniecznie mają związek ze stosowaniem danego leku lub są spowodowane przez ten lek.
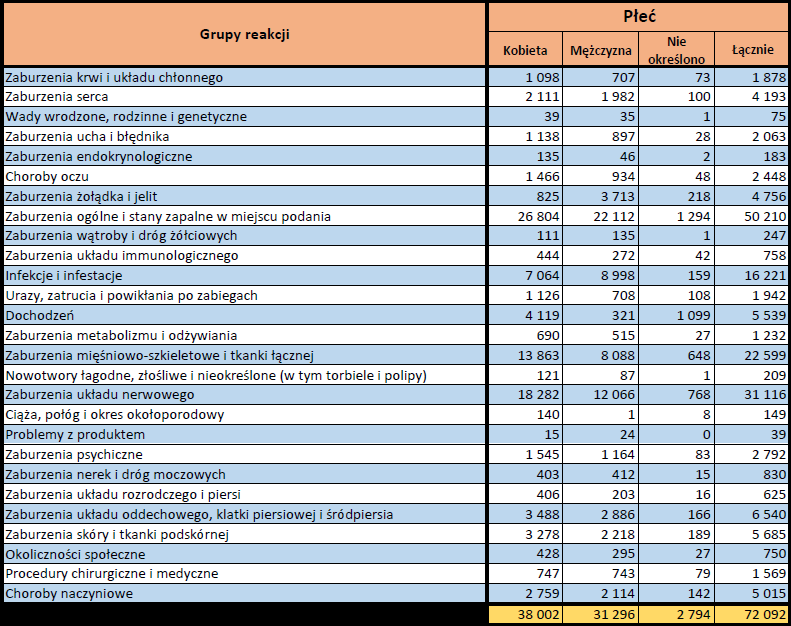
Kompleksowe raporty internetowe obejmują następujące dane:
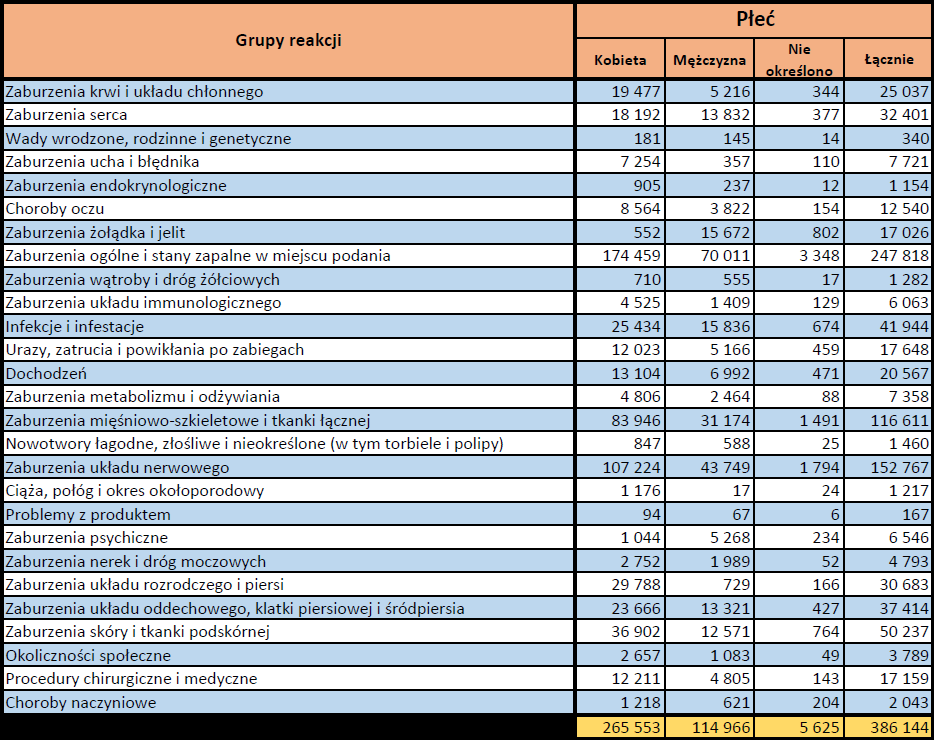
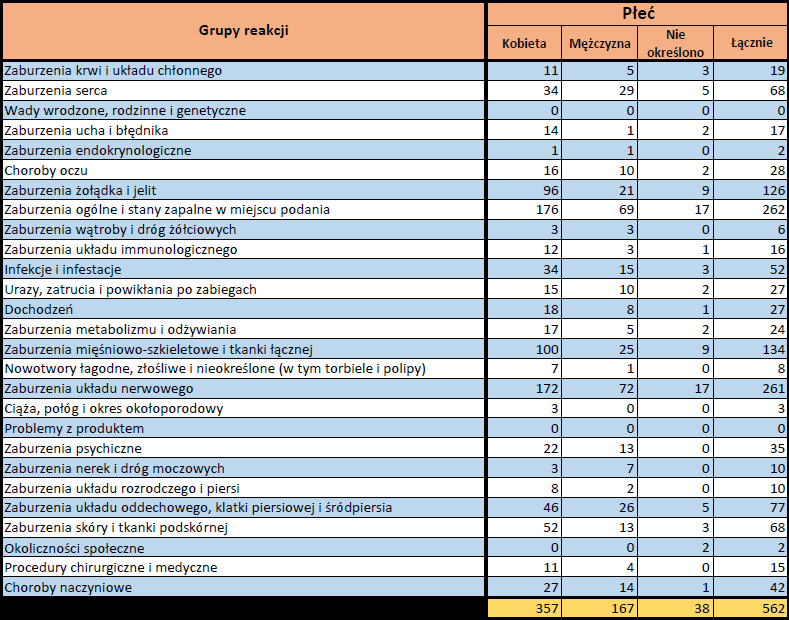
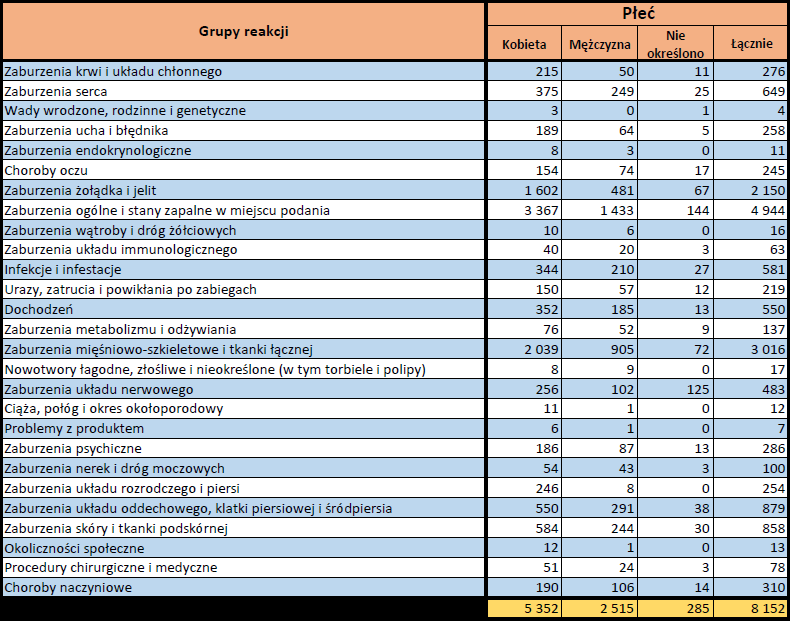
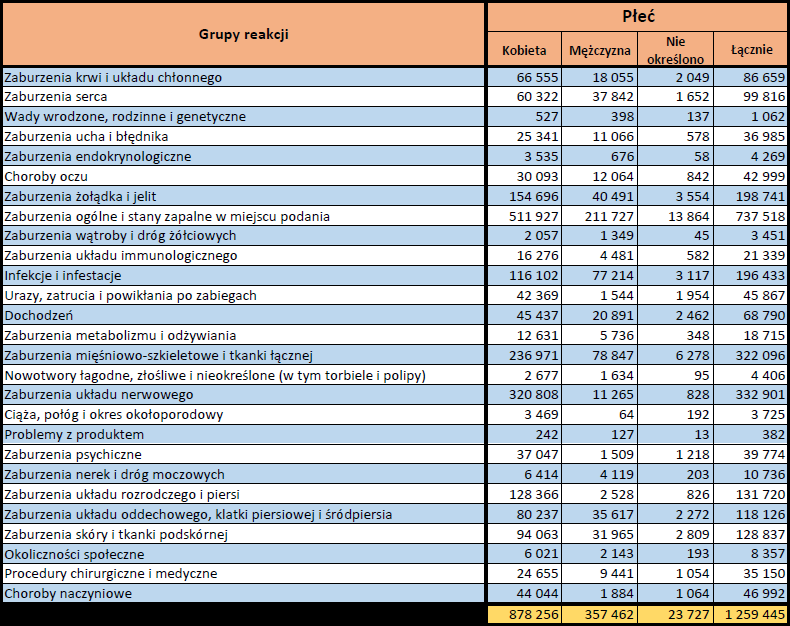
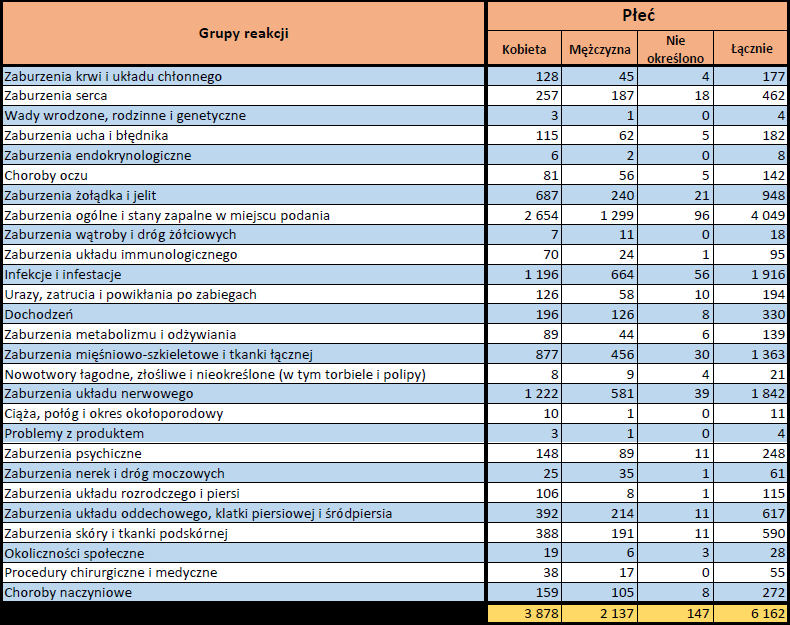
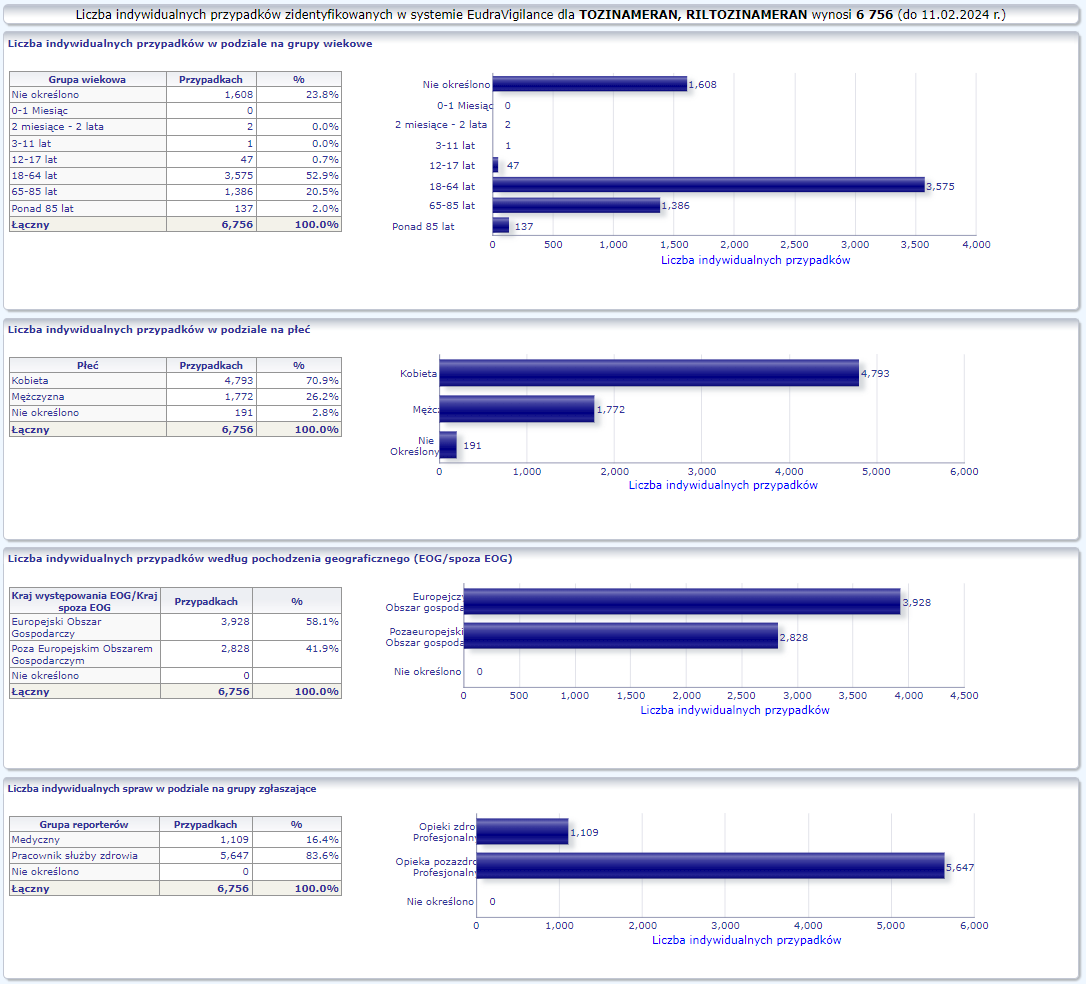
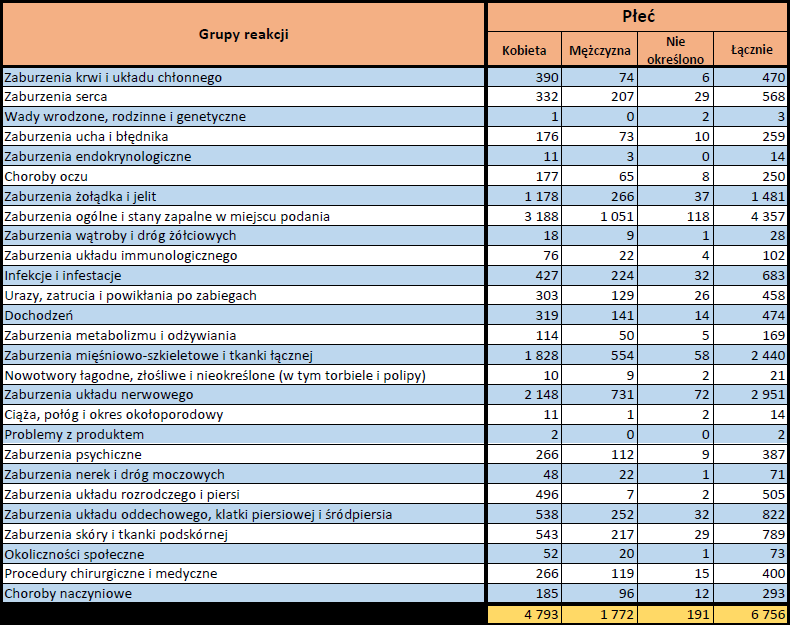
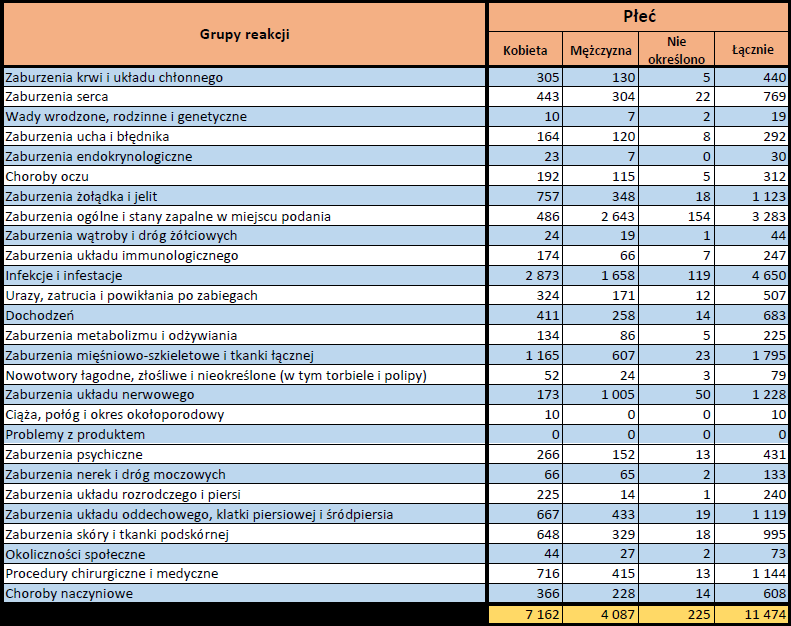
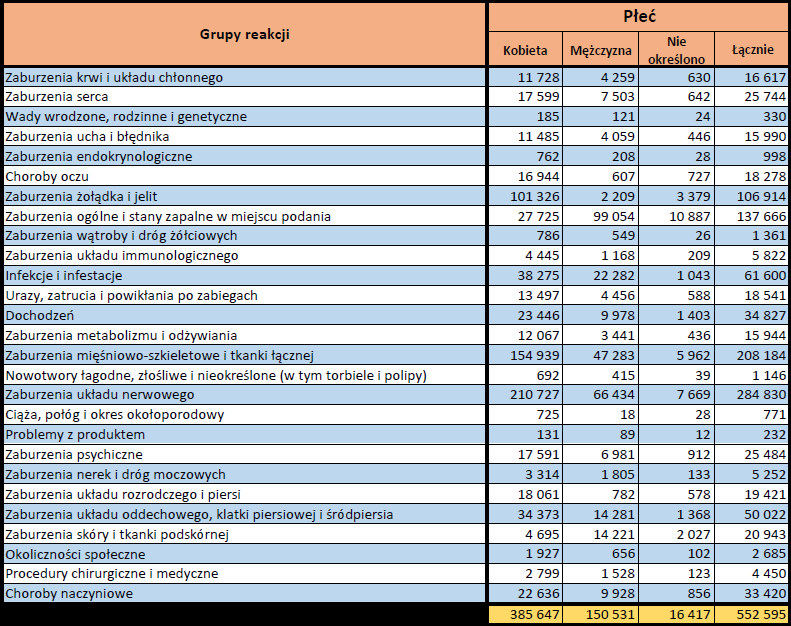
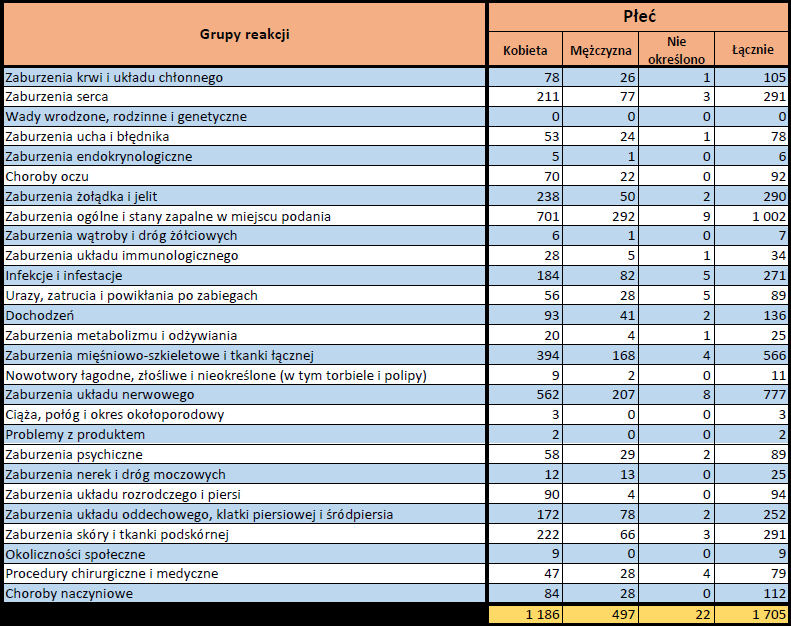
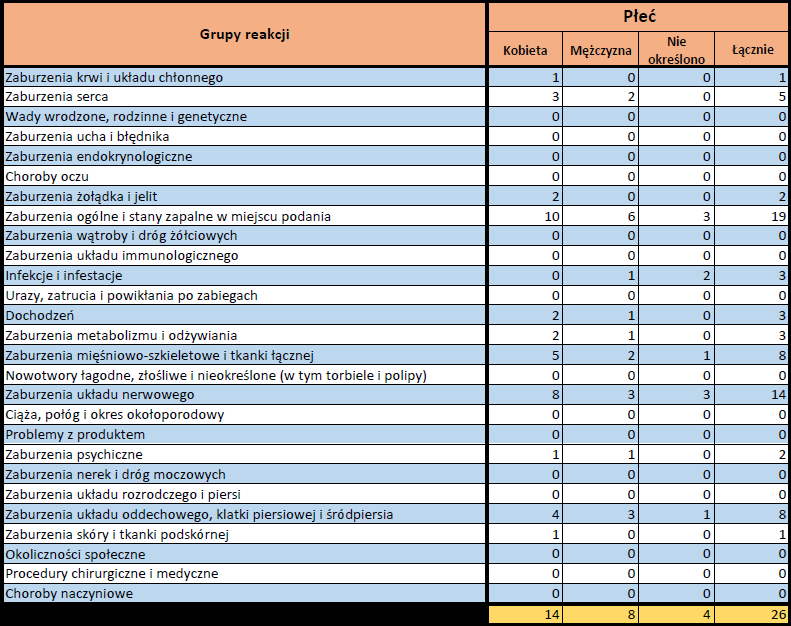
- Grupa wiekowa i płeć – źródło informacji o osobie, u której wystąpiło podejrzewane działanie niepożądane.
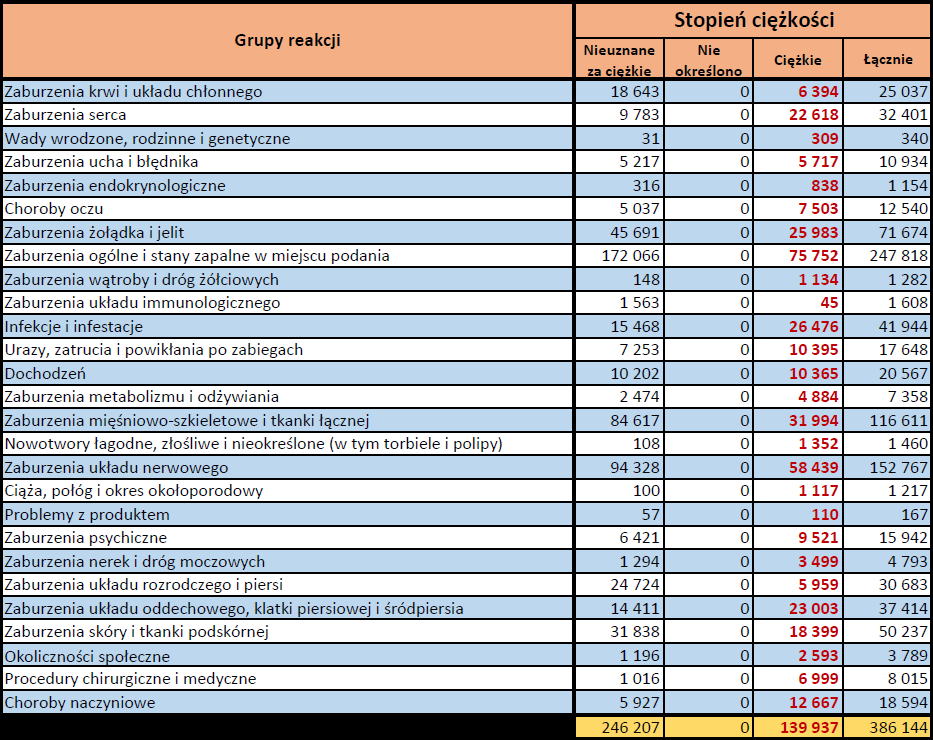
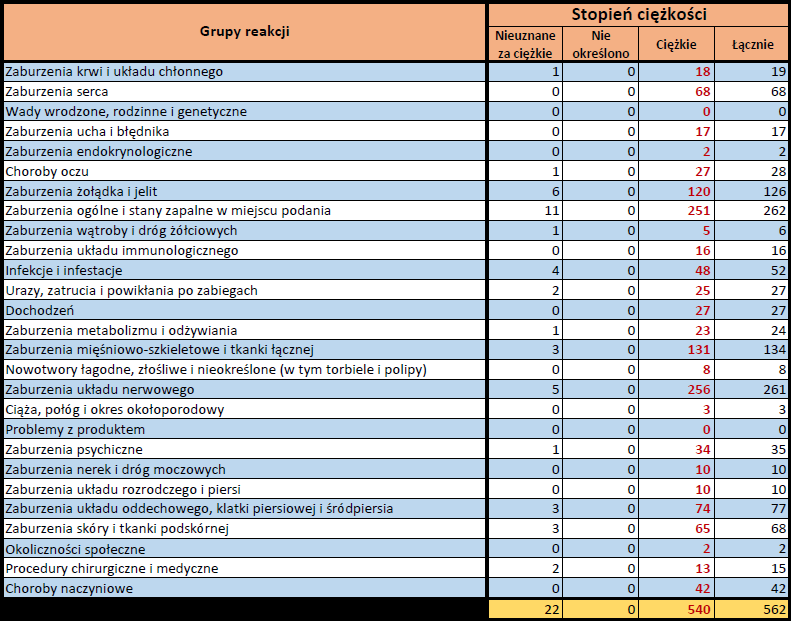
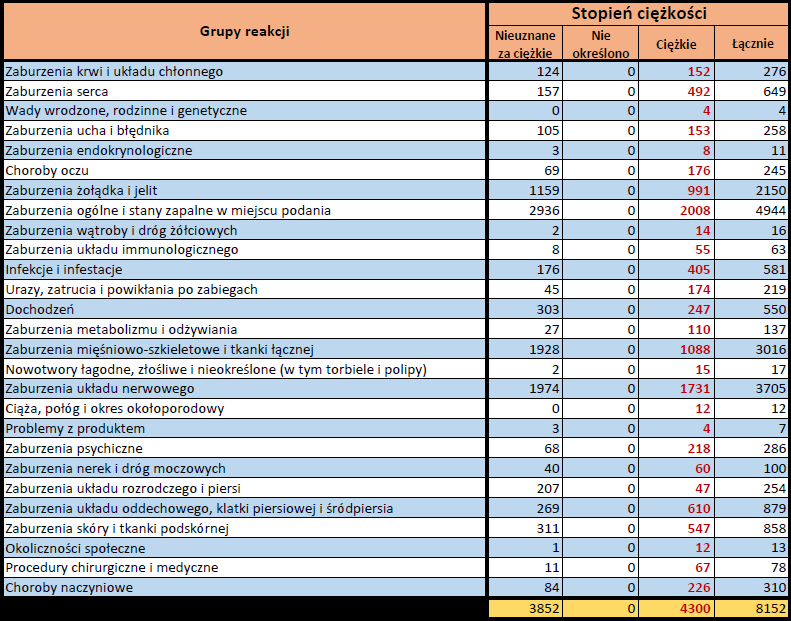
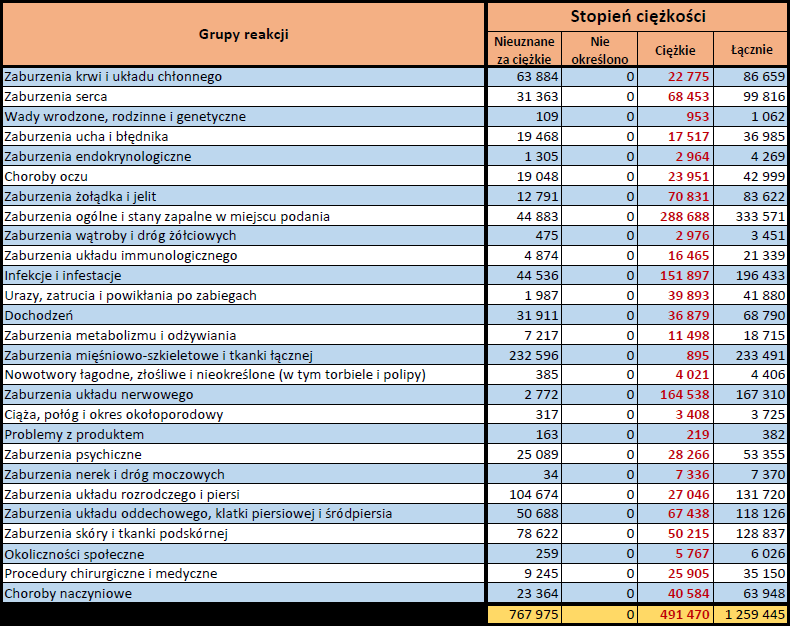
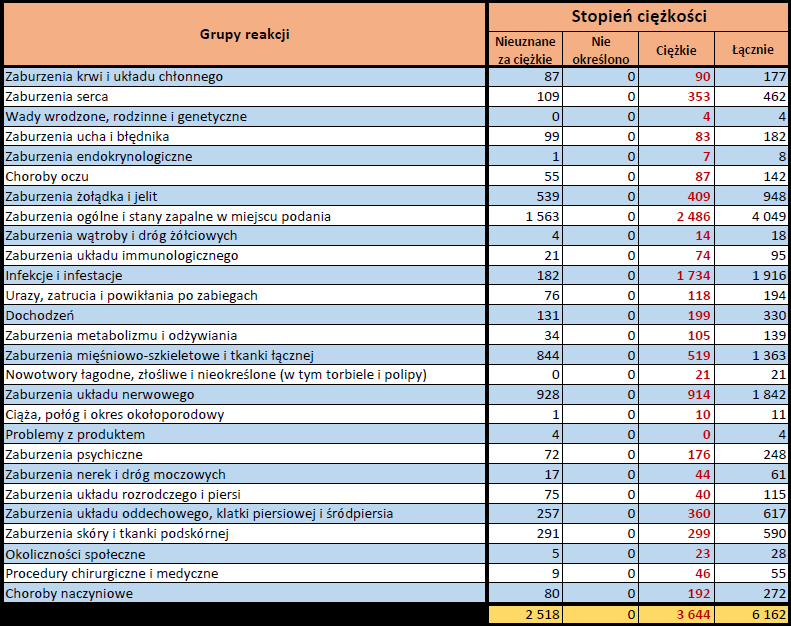
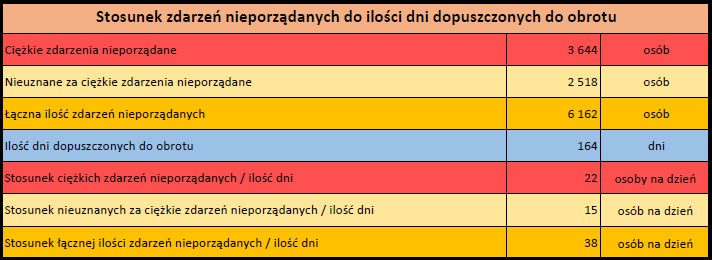
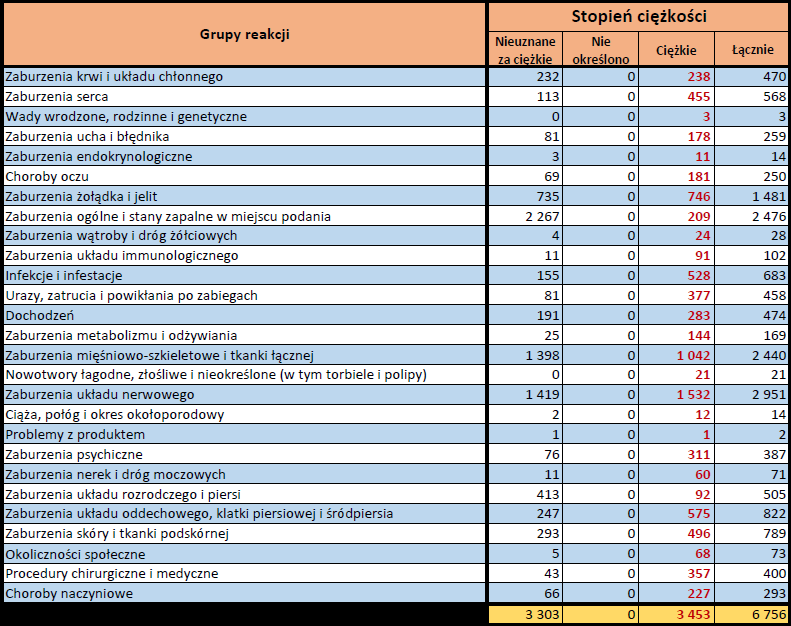
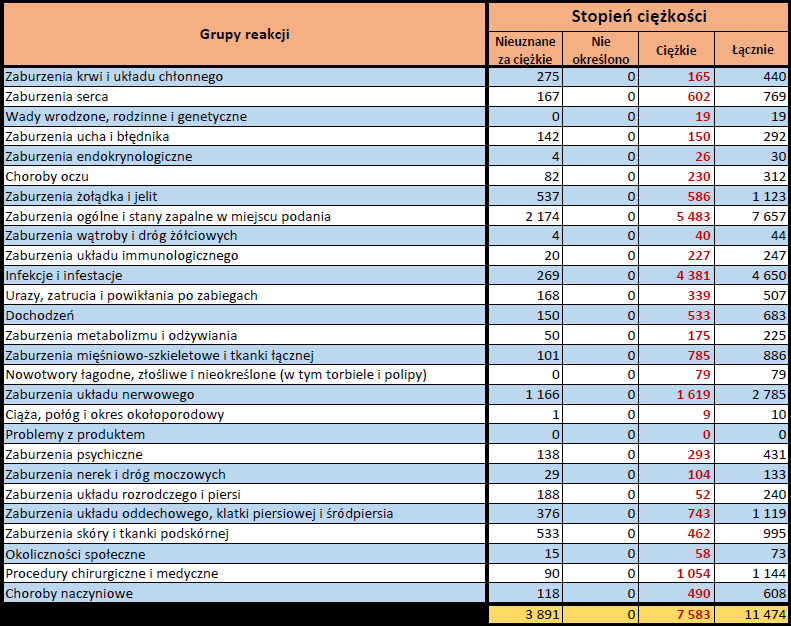
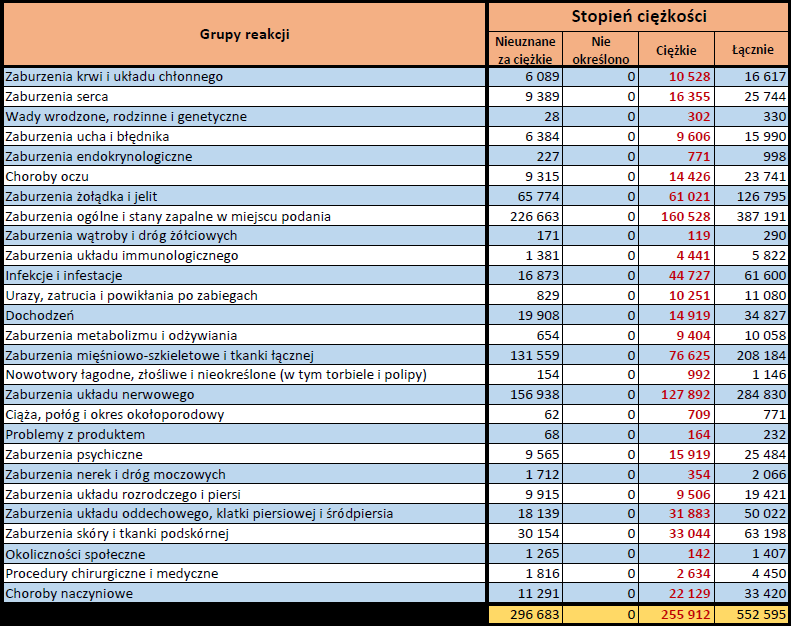
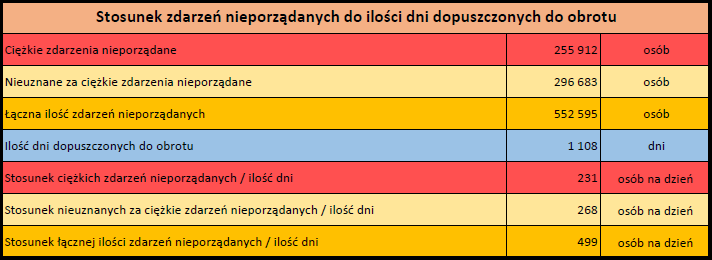
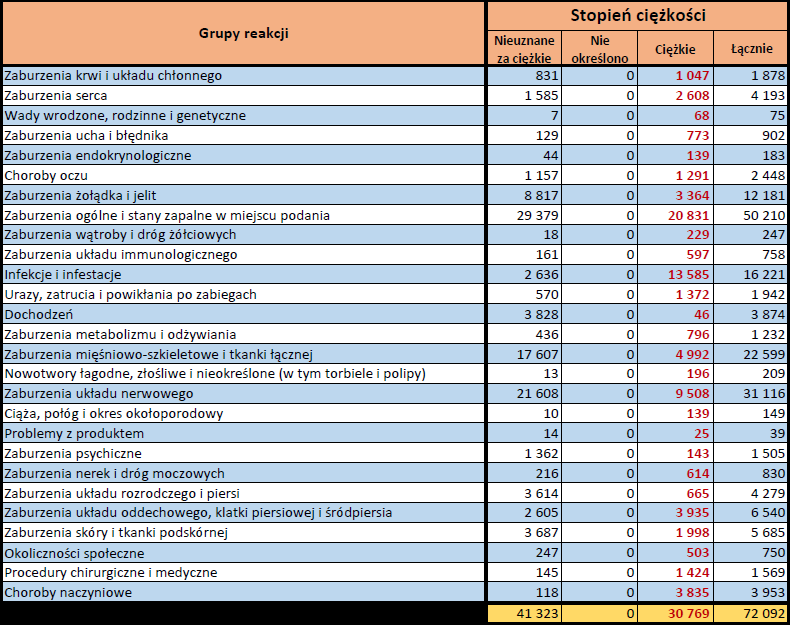
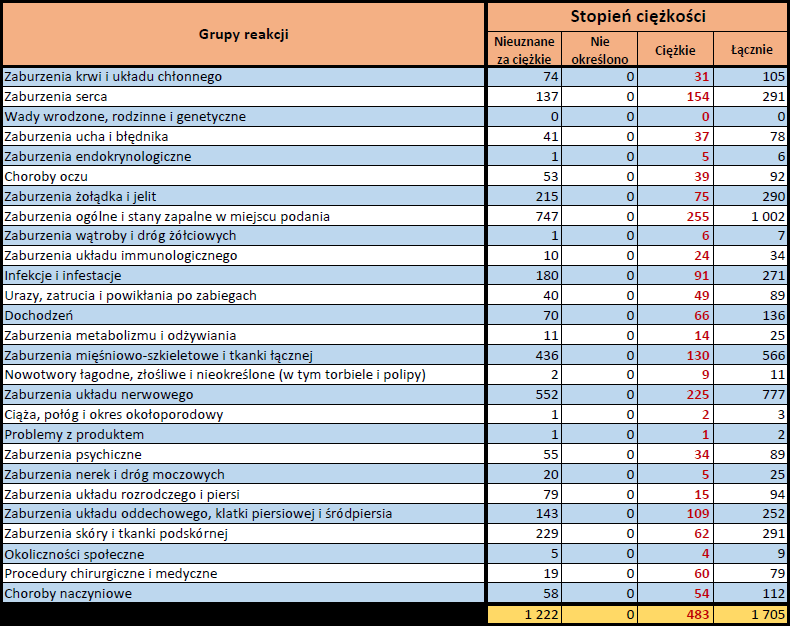
- Stopień ciężkości – źródło informacji na temat podejrzewanego działania niepożądanego; można je określić jako „ciężkie”, jeśli powoduje śmierć, stanowi zagrożenie dla życia, wymaga hospitalizacji,
jest przyczyną innych zaburzeń istotnych ze względów medycznych lub przedłużenia czasu pobytu w szpitalu, powoduje trwałe lub istotne inwalidztwo albo niesprawność organizmu, lub jest wadą rozwojową/wrodzoną. Może również dotyczyć innych istotnych zdarzeń natury medycznej, które nie muszą stanowić bezpośredniego zagrożenia życia ani powodować śmierci lub hospitalizacji, ale mogą narazić pacjenta na niebezpieczeństwo lub wymagać interwencji (leczenia), aby zapobiec jednemu z pozostałych wymienionych wyżej skutków. Do takich przykładowych zdarzeń zalicza się alergiczny skurcz oskrzeli (poważny problem z oddychaniem) wymagający leczenia w szpitalnym oddziale ratunkowym lub w domu, a także drgawki i nieprawidłowe zmiany składu krwi (dyskrazje, zaburzenia krwi), które nie prowadzą do hospitalizacji. - Grupa osoby zgłaszającej – źródło informacji dotyczących kwalifikacji osoby zgłaszającej.
- Przedstawiciel fachowego personelu medycznego (lekarz, farmaceuta lub inny przedstawiciel fachowego personelu medycznego),
- Osoba niebędąca przedstawicielem fachowego personelu medycznego (prawnik, konsument lub inna osoba niebędąca przedstawicielem fachowego personelu medycznego).
- Zgłoszone podejrzewane działanie niepożądane – źródło informacji dotyczących działania niepożądanego/działań niepożądanych, jakie wystąpiły u pacjenta według osoby zgłaszającej.
Ważne wiadomości na temat COVID-19
- Informacje na tej stronie dotyczą podejrzewanych skutków ubocznych, tj. zdarzeń medycznych, które zaobserwowano po podaniu szczepionek przeciwko COVID-19, ale które niekoniecznie są związane ze szczepionką lub przez nią spowodowane. Zdarzenia te mogły być spowodowane chorobą współistniejącą lub być związane z innym lekiem przyjmowanym przez pacjenta w tym samym czasie.
- Ocena naukowa EMA uwzględnia wiele innych czynników, takich jak historia choroby pacjenta, częstość podejrzewanych działań niepożądanych w populacji zaszczepionej w porównaniu z częstością w populacji ogólnej oraz czy jest biologicznie prawdopodobne, że szczepionka mogła spowodować wydarzenie.
- Ta strona internetowa nie podaje całkowitej liczby zgłoszonych przypadków zakończonych zgonem.
MODERNA (ELASOMERAN)
Warunkowe pozwolenie na dopuszczenie do obrotu w wydane: 06/01/2021
Obecna nazwa Spikevax
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (1131 dni od dopuszczenia do obrotu)
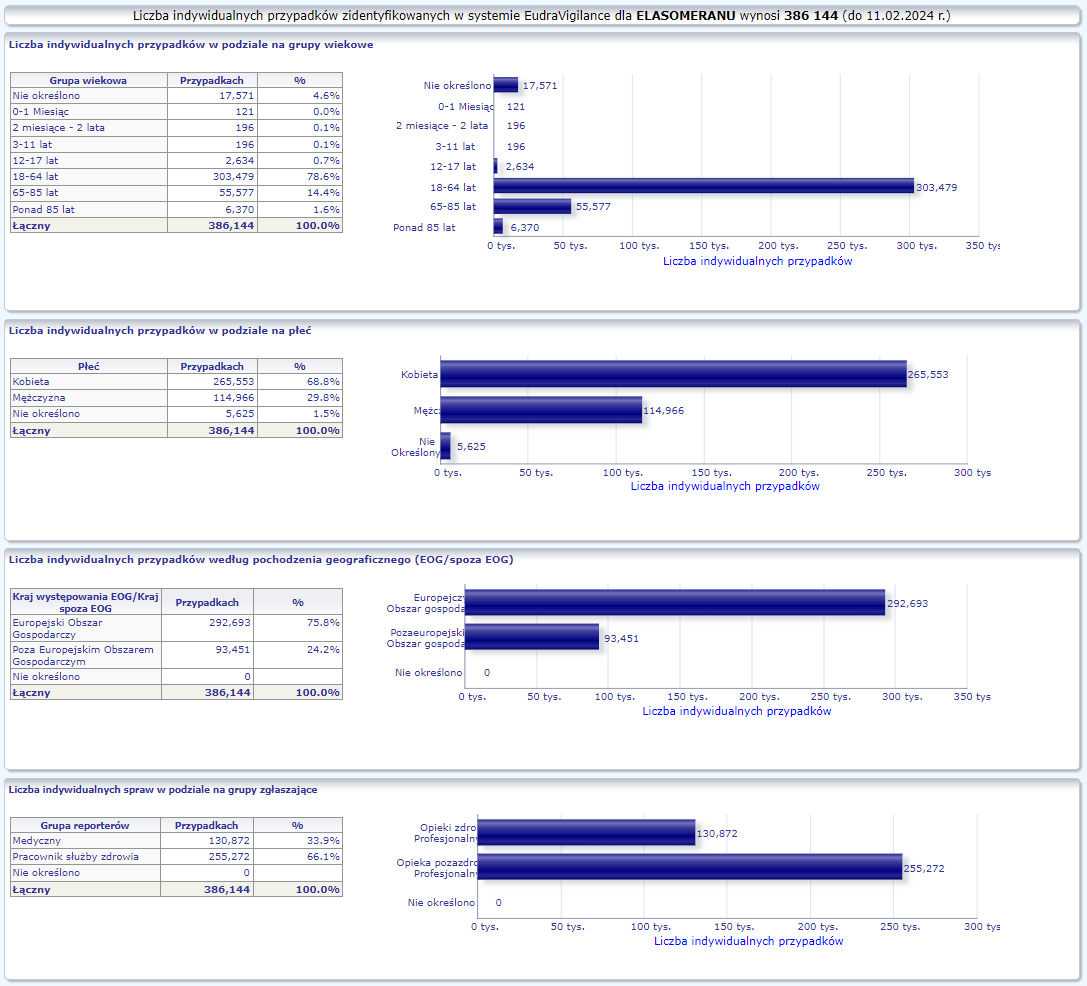
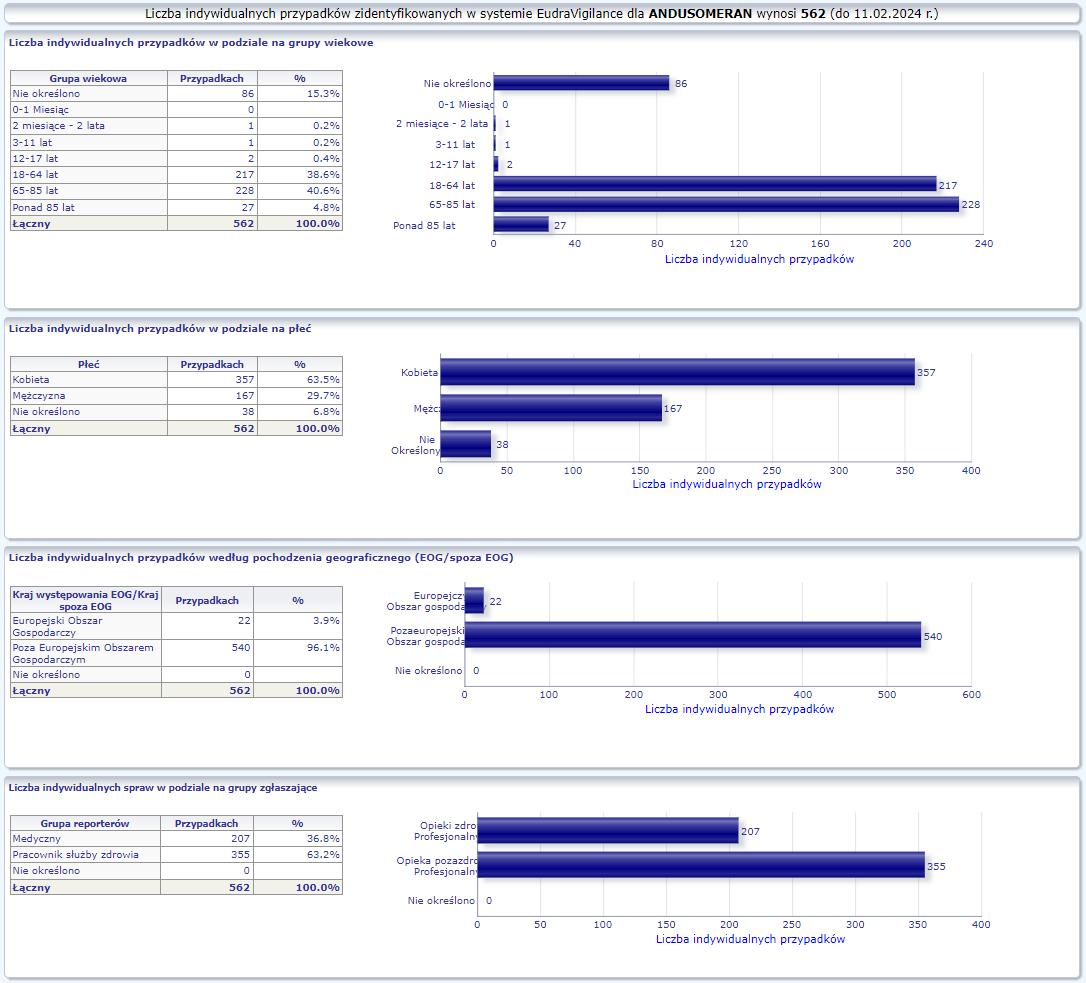
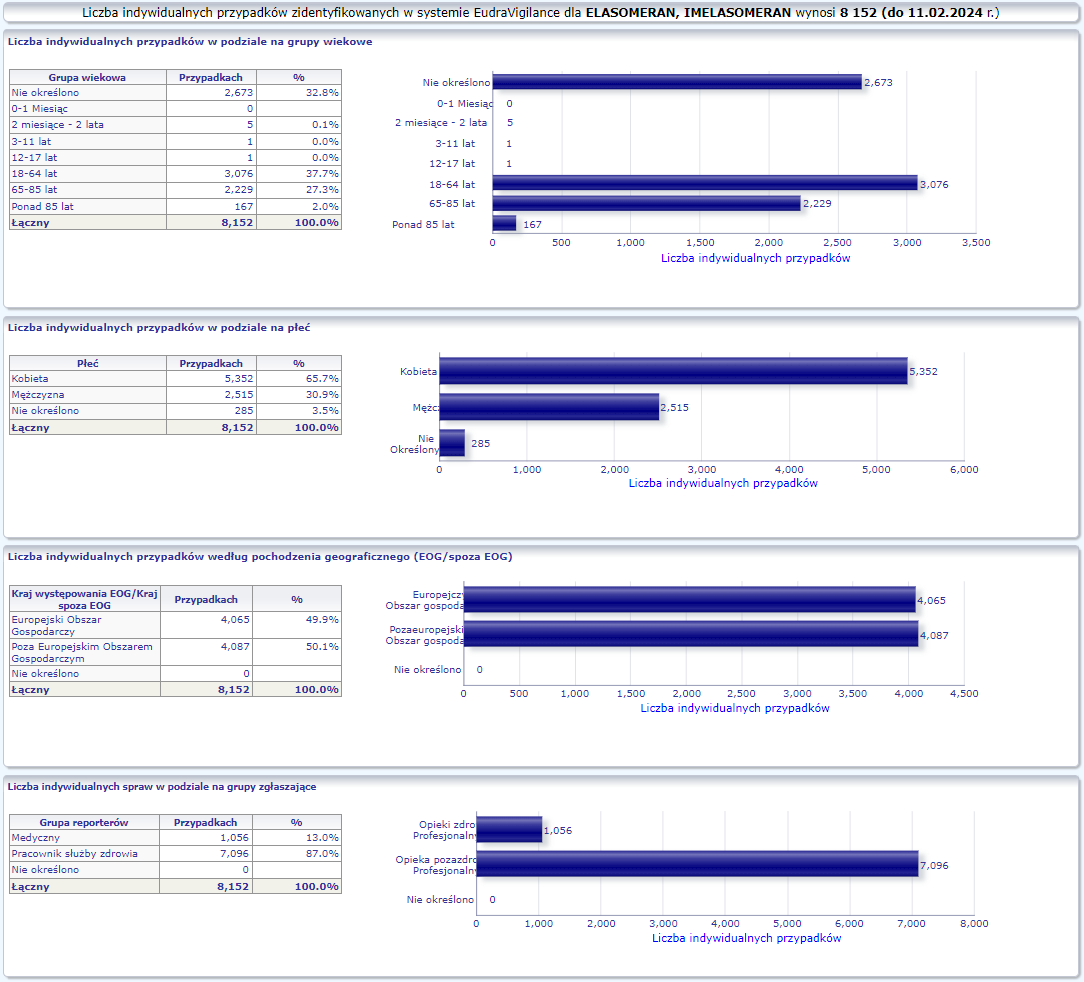
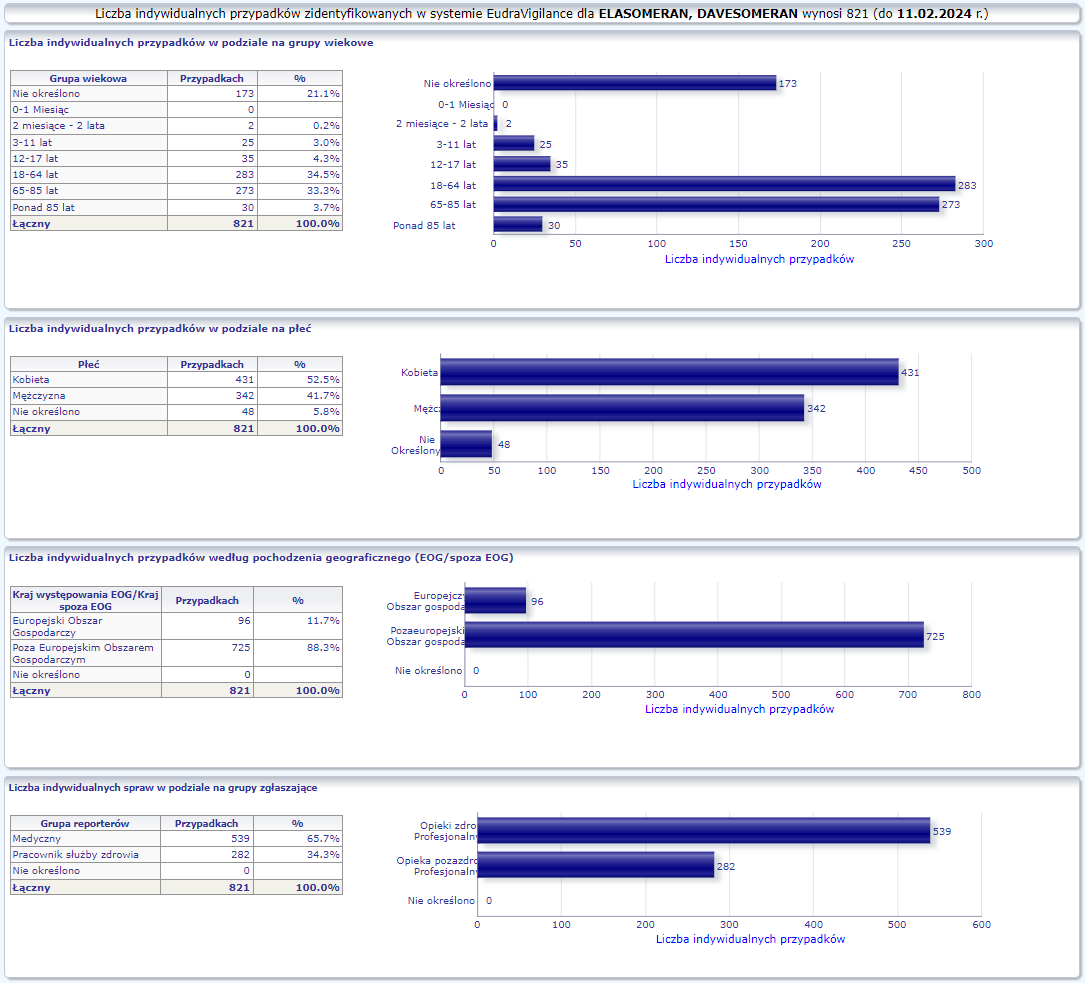
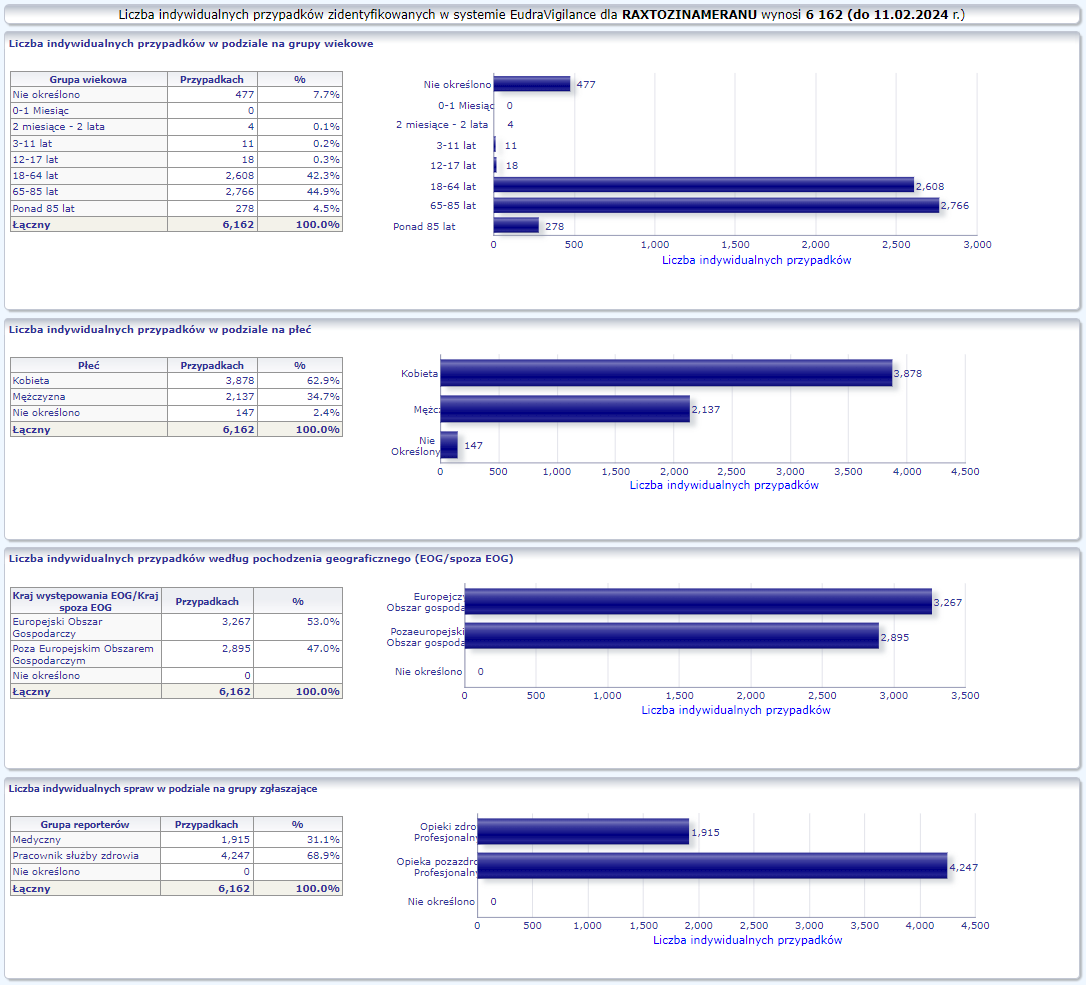
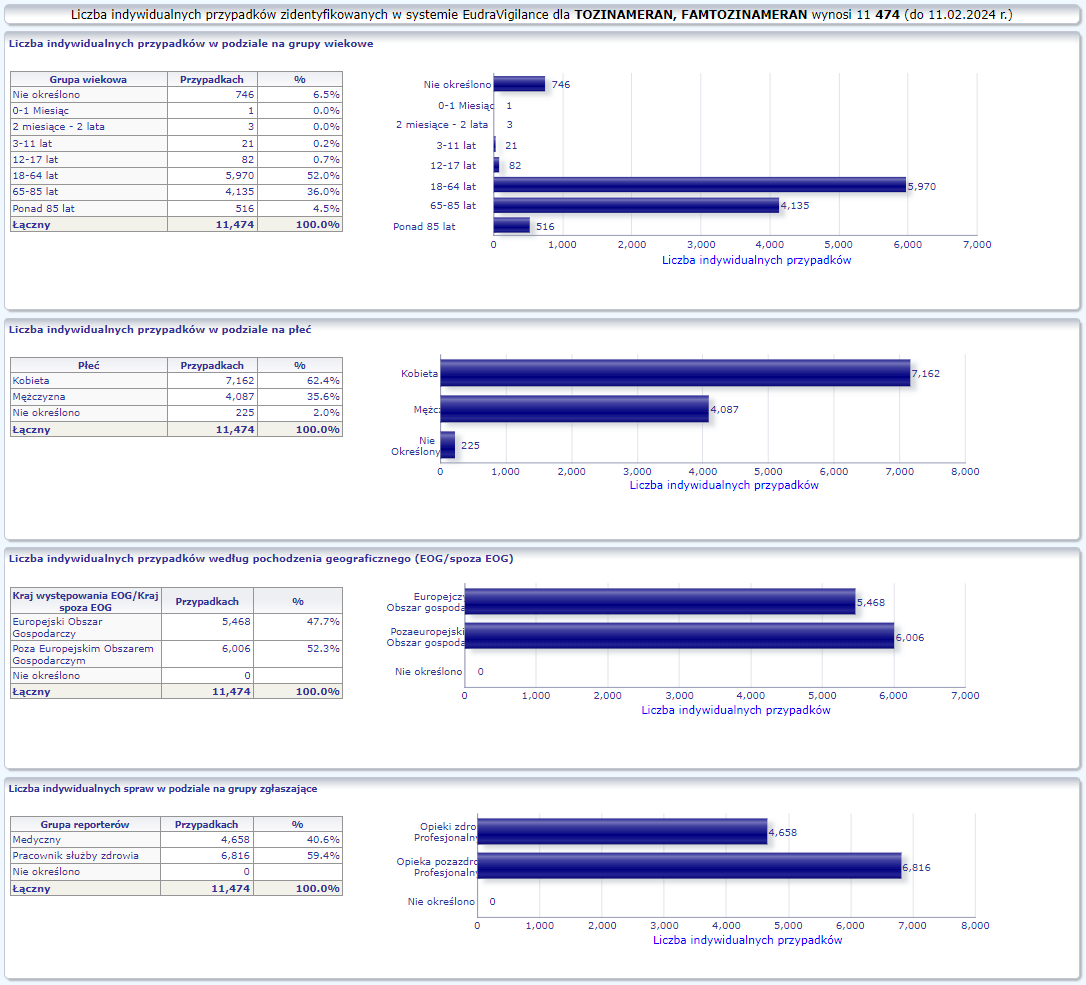
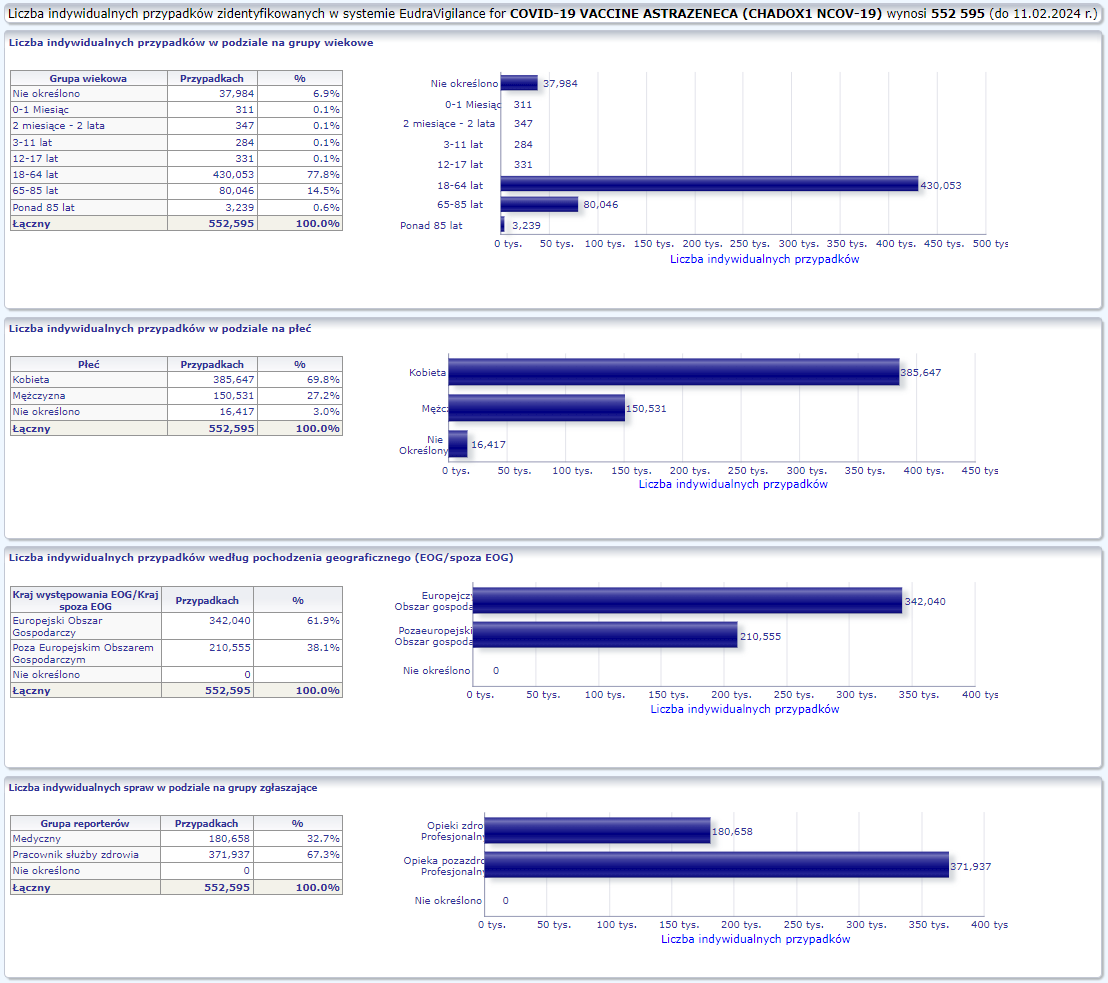
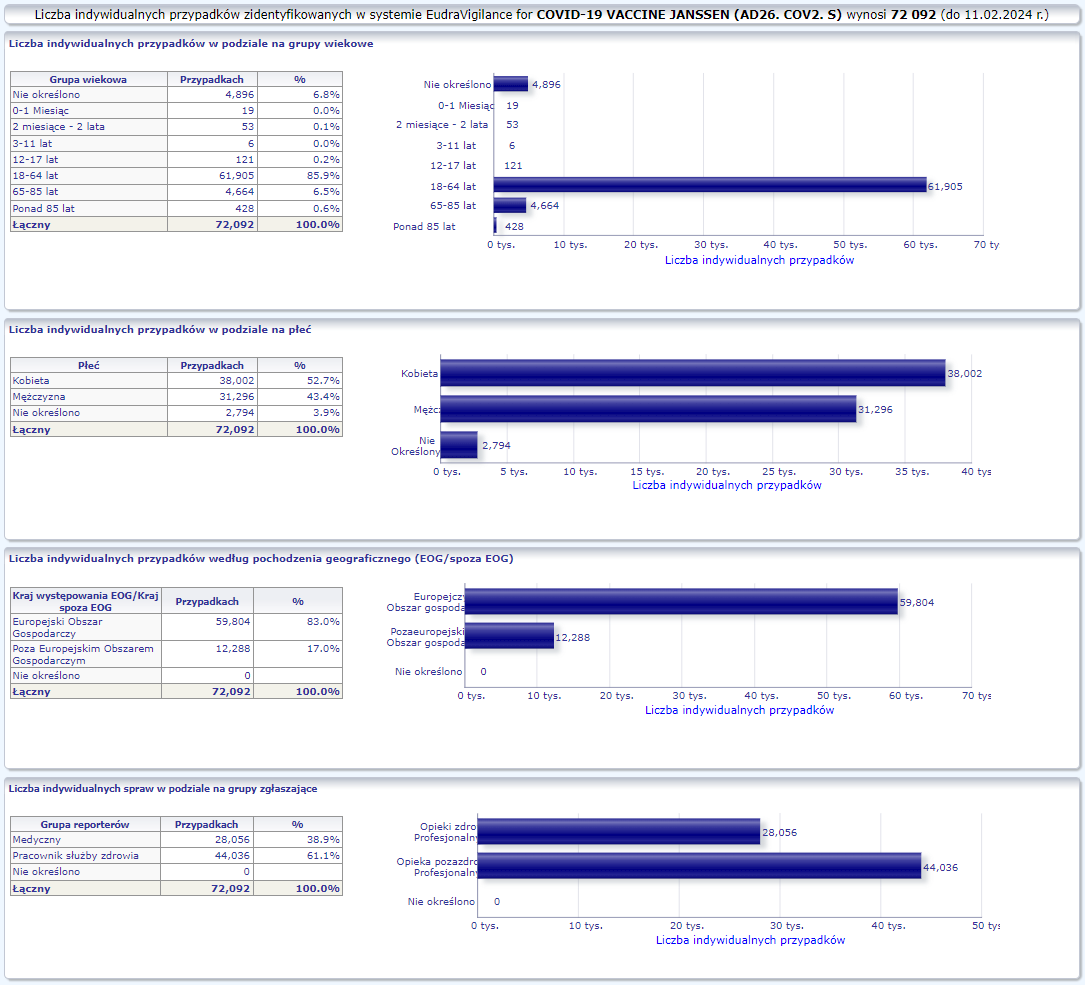
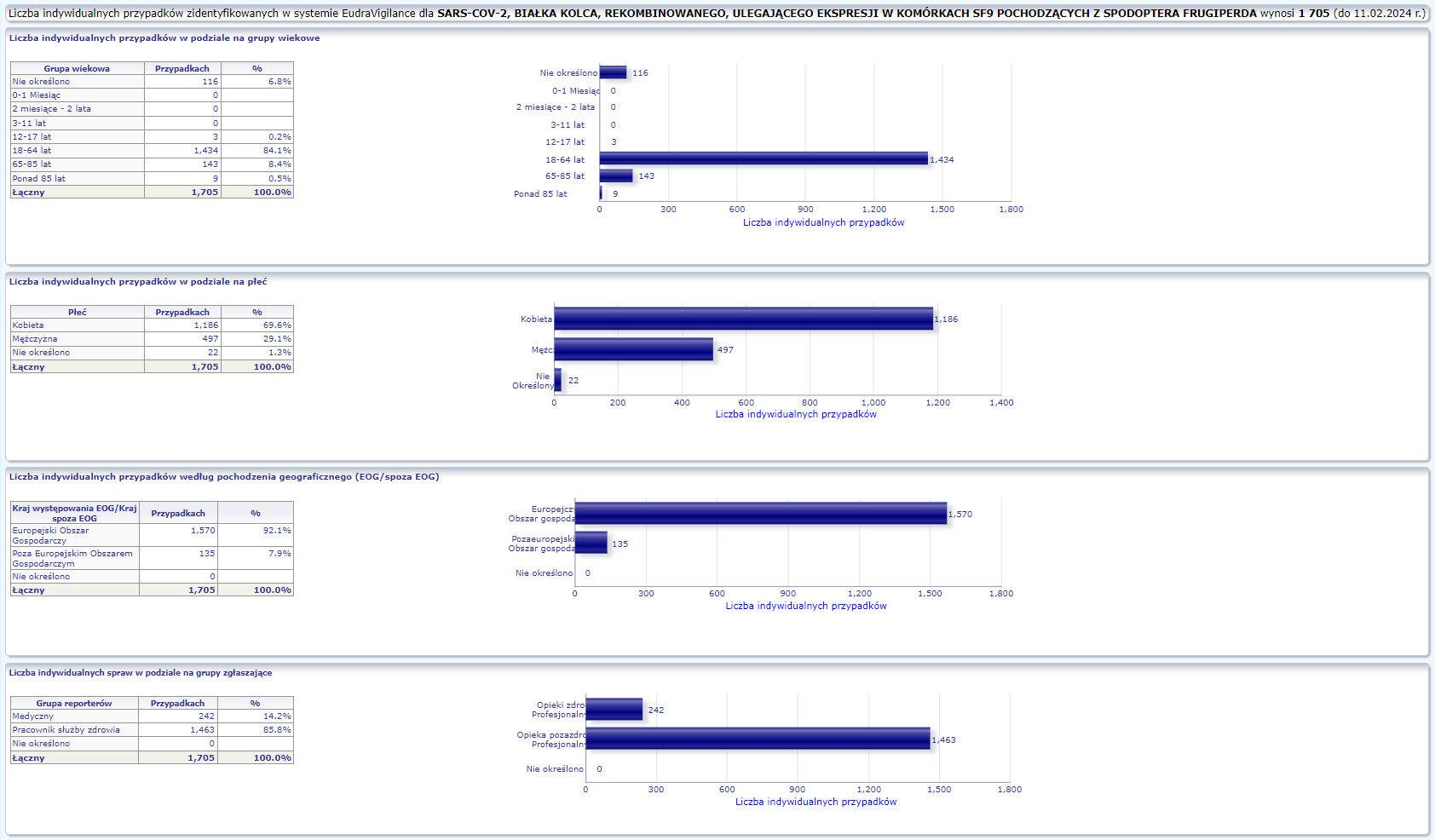
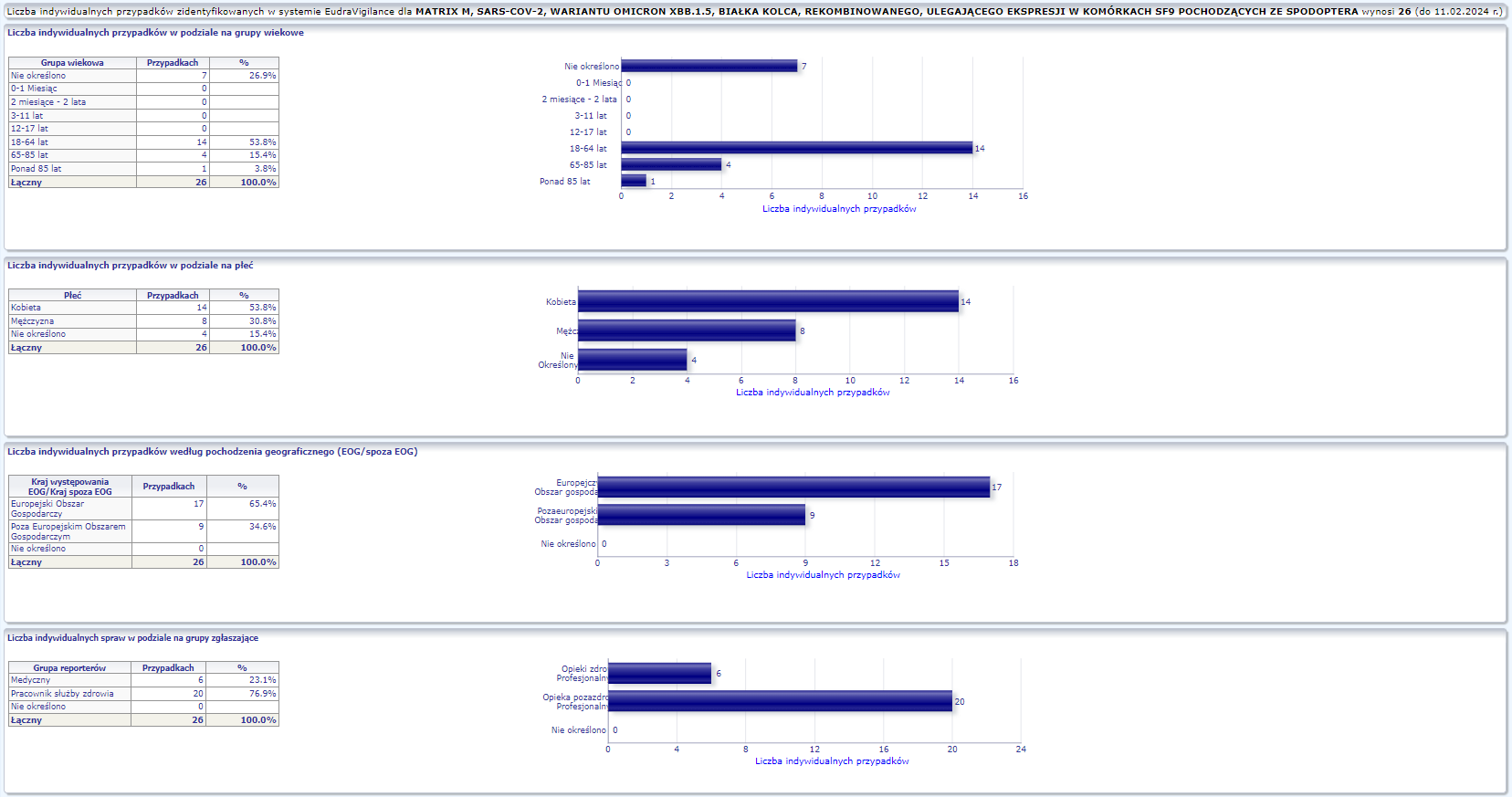
W tej zakładce przedstawiona jest bieżąca liczba indywidualnych przypadków zidentyfikowanych w systemie EudraVigilance do końca poprzedniego tygodnia. Zakładka zawiera informacje dotyczące liczby indywidualnych przypadków w zależności od grupy wiekowej, płci i pochodzenia geograficznego.
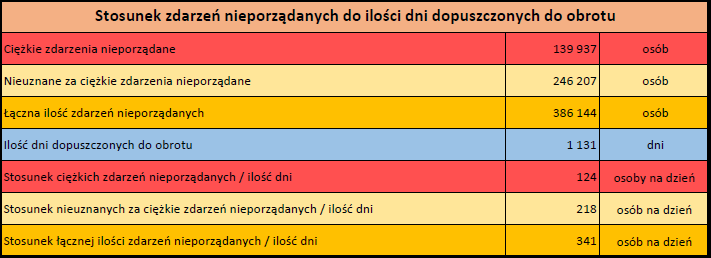
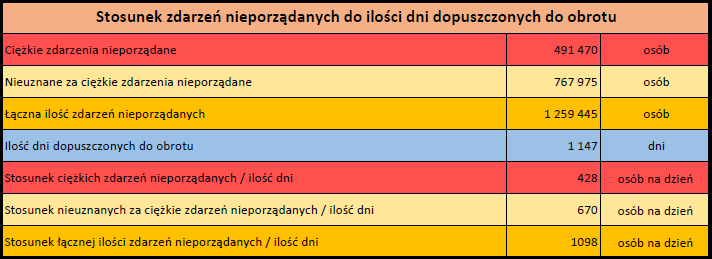
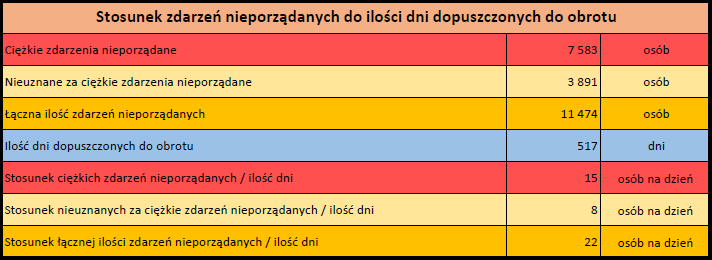
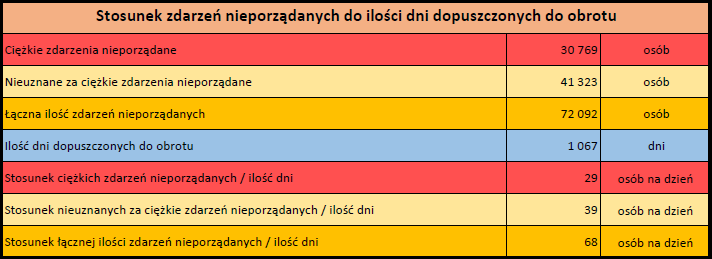
Ponieważ indywidualny przypadek może zawierać więcej niż jedno podejrzenie działania ubocznego, informacja ta nie oznacza całkowitej liczby indywidualnych przypadków przesłanych do systemu EudraVigilance, lecz liczbę powiązanych działań ubocznych.
Bieżąca liczba indywidualnych przypadków zaznaczona jest kolorem żółtym.
MODERNA OMICRON XBB.1.5 (ANDUSOMERAN)
Spikevax XBB.1.5 (dostosowany) dopuszczony do obrotu: 15/09/2023
Obecna nazwa Spikevax
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (149 dni od dopuszczenia do obrotu)
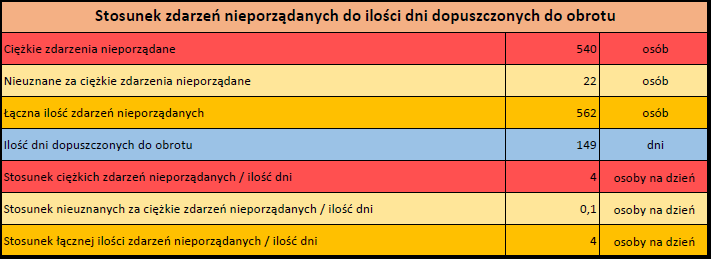
MODERNA ORIGINAL/OMICRON BA.1 (ELASOMERAN, IMELASOMERAN)
Spikevax bivalent Original/Omicron BA.1 (dostosowany) dopuszczony do obrotu: 01/09/2022
Obecna nazwa Spikevax
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (528 dni od dopuszczenia do obrotu)
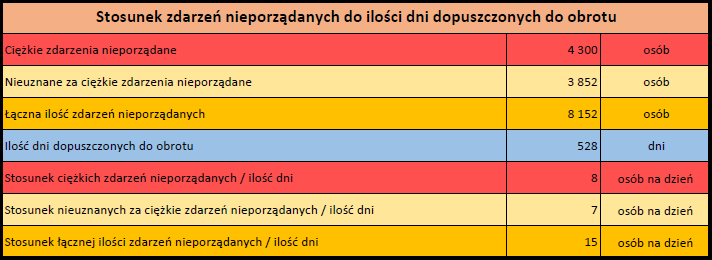
MODERNA ORIGINAL/OMICRON BA.4-5 (ELASOMERAN, DAVESOMERAN)
Szczepionka Spikevax bivalent Original/Omicron BA.4-5 (dostosowany) dopuszczona do obrotu: 20/10/2022
Obecna nazwa Spikevax
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (479 dni od dopuszczenia do obrotu)
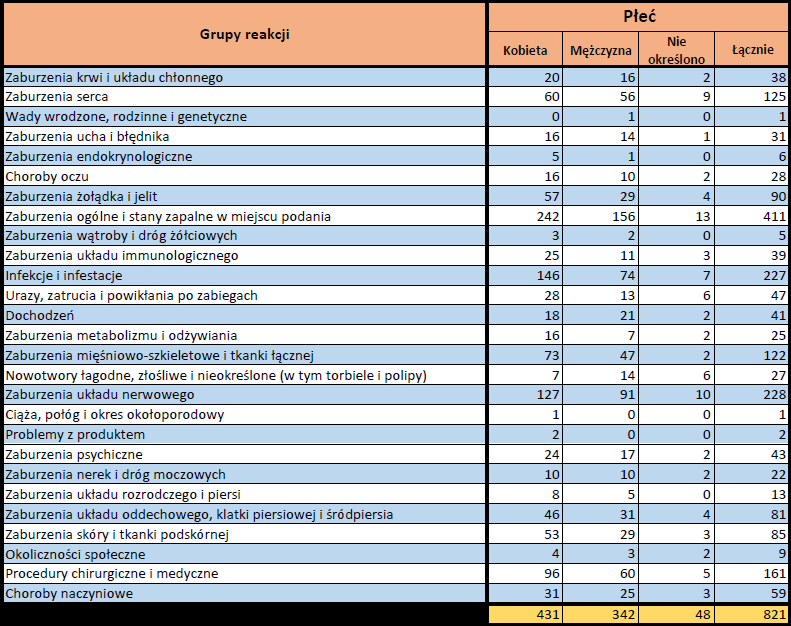
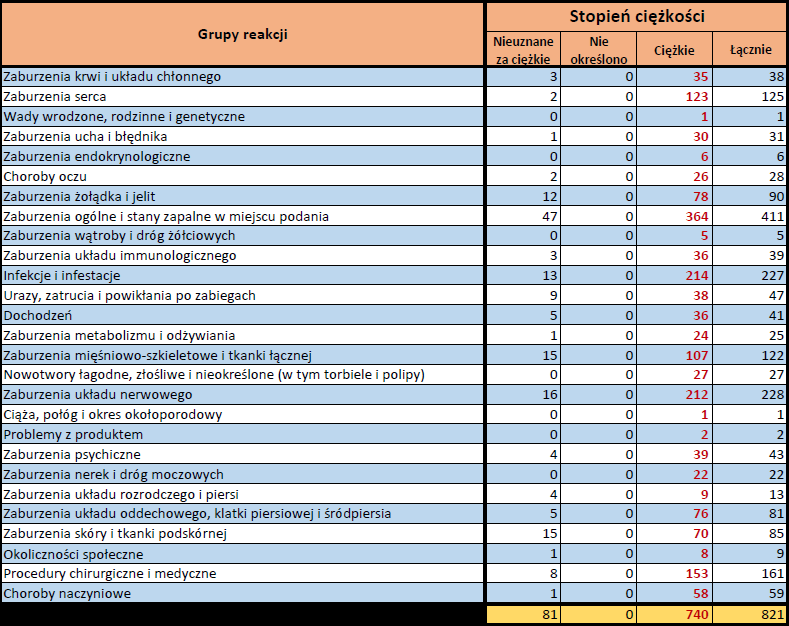
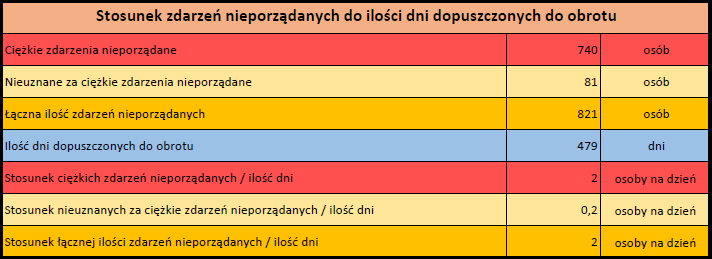
PFIZER-BIONTECH (TOZINAMERAN)
Warunkowe pozwolenie na dopuszczenie do obrotu wydane: 21/12/2020
Obecna nazwa Comirnaty
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (1147 dni od dopuszczenia do obrotu)
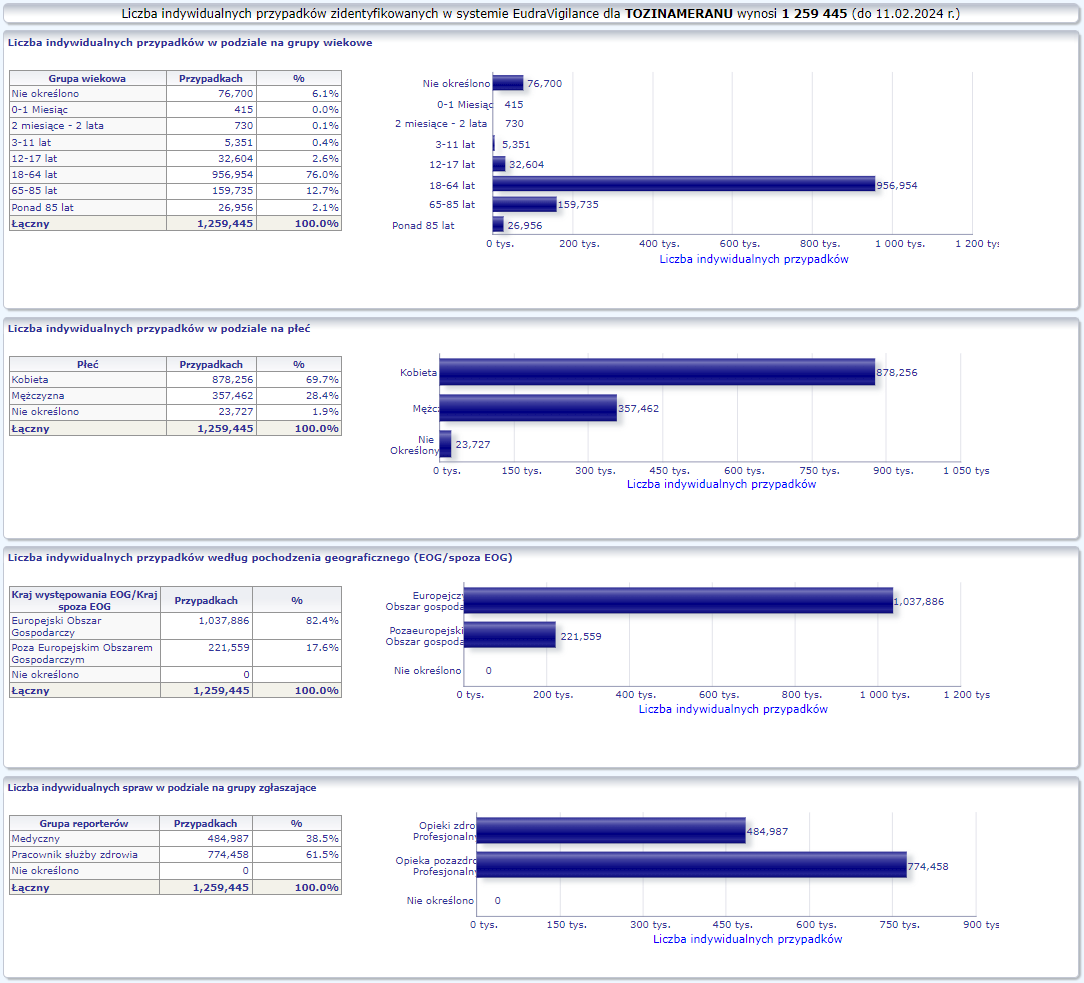
PFIZER-BIONTECH OMICRON XBB.1.5 (RAXTOZINAMERAN)
Comirnaty Omicron XBB.1.5 (dostosowany) dopuszczony do obrotu: 31/08/2023
Obecna nazwa Comirnaty
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (164 dni od dopuszczenia do obrotu)
PFIZER-BIONTECH ORIGINAL/OMICRON BA.1 (TOZINAMERAN, RILTOZINAMERAN)
Comirnaty Original/Omicron BA.1 (dostosowany) dopuszczony do obrotu: 01/09/2022
Obecna nazwa Comirnaty
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (528 dni od dopuszczenia do obrotu)
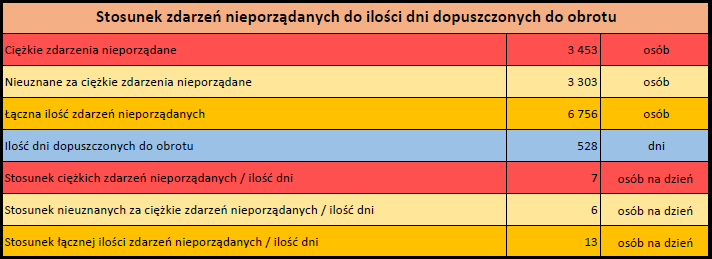
PFIZER-BIONTECH ORIGINAL/OMICRON BA.4-5 (TOZINAMERAN, FAMTOZINAMERAN)
Comirnaty Original/Omicron BA.4-5 (dostosowany) dopuszczony do obrotu: 12/09/2022
Obecna nazwa Comirnaty
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (517 dni od dopuszczenia do obrotu)
ASTRAZENECA (CHADOX1 NCOV-19)
Warunkowe pozwolenie na dopuszczenie do obrotu wydane: 29/01/2021
Obecna nazwa Vaxzevria
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (1108 dni od dopuszczenia do obrotu)
JANSSEN (AD26.COV2.S)
Warunkowe pozwolenie na dopuszczenie do obrotu wydane: 11/03/2021
Obecna nazwa Jcovden
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (1067 dni od dopuszczenia do obrotu)
NOVAVAX (NVX-COV2373)
Warunkowe pozwolenie na dopuszczenie do obrotu wydane: 20/12/2021
Obecna nazwa Nuvaxovid
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (783 dni od dopuszczenia do obrotu)

NOVAVAX XBB.1.5 (NVX-COV2373)
Nuvaxovid XBB.1.5 (dostosowany) dopuszczony do obrotu: 31.10.2023
Obecna nazwa Nuvaxovid
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (103 dni od dopuszczenia do obrotu)
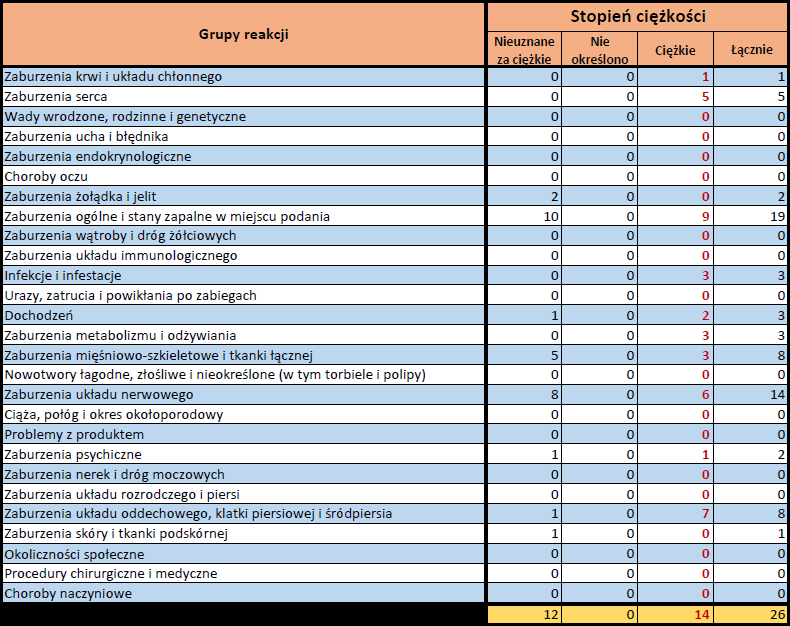
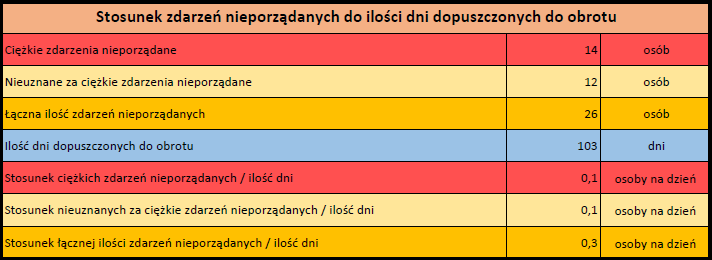
VIDPREVTYN BETA
Wydane pozwolenie na dopuszczenie do obrotu: 10/11/2022
Działania niepożądane zgłoszone do dnia 11.02.2024 r. (458 dni od dopuszczenia do obrotu)

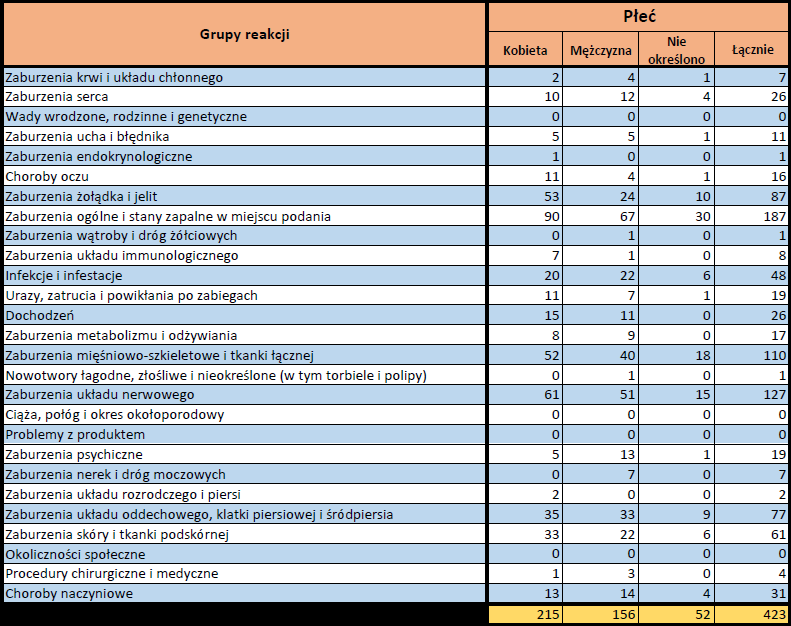
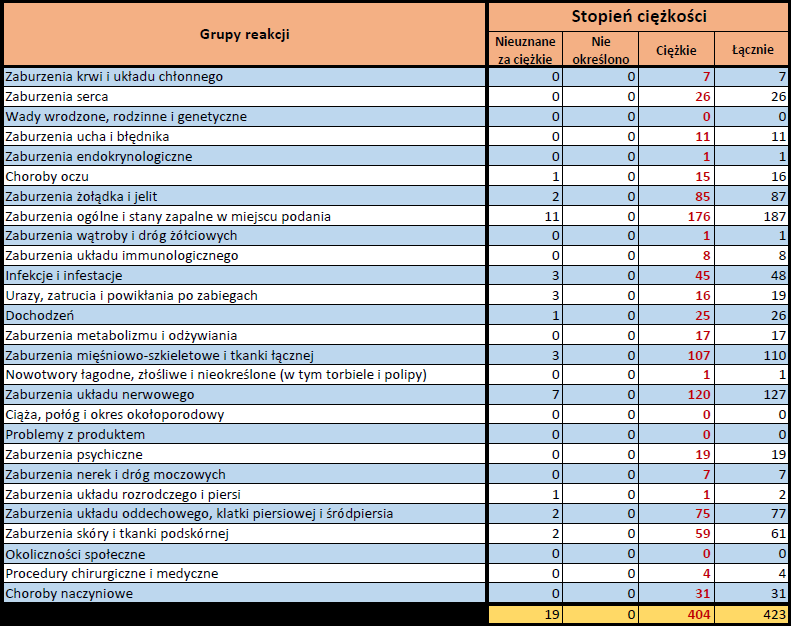
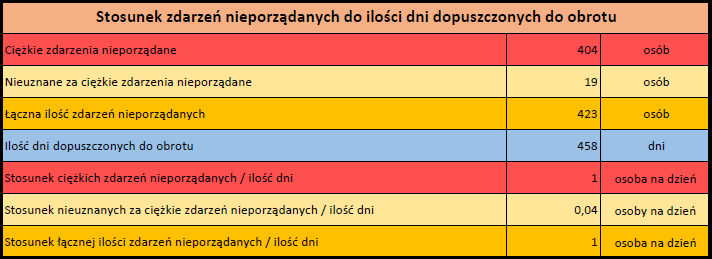
Podsumowanie
Działania niepożądane zgłoszone do dnia 11.02.2024 r.

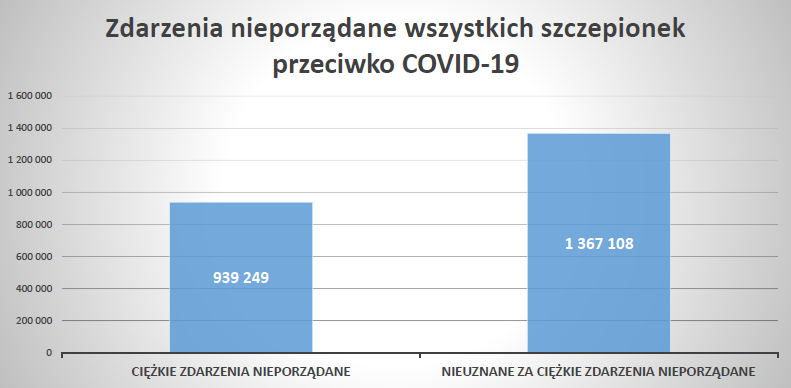
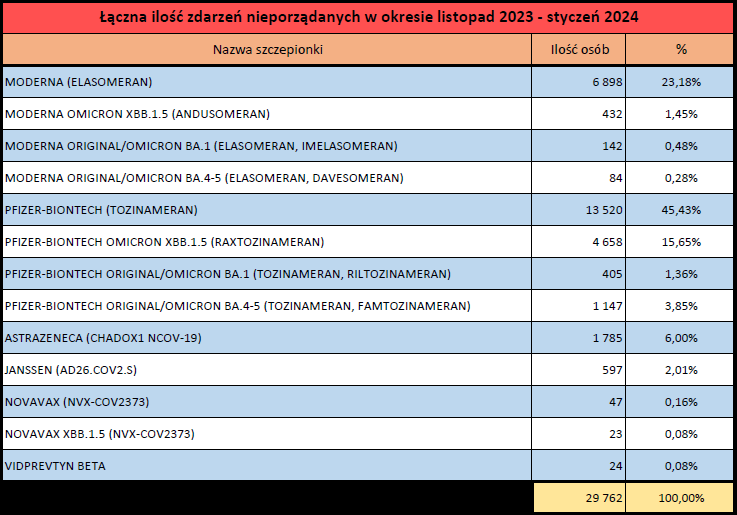
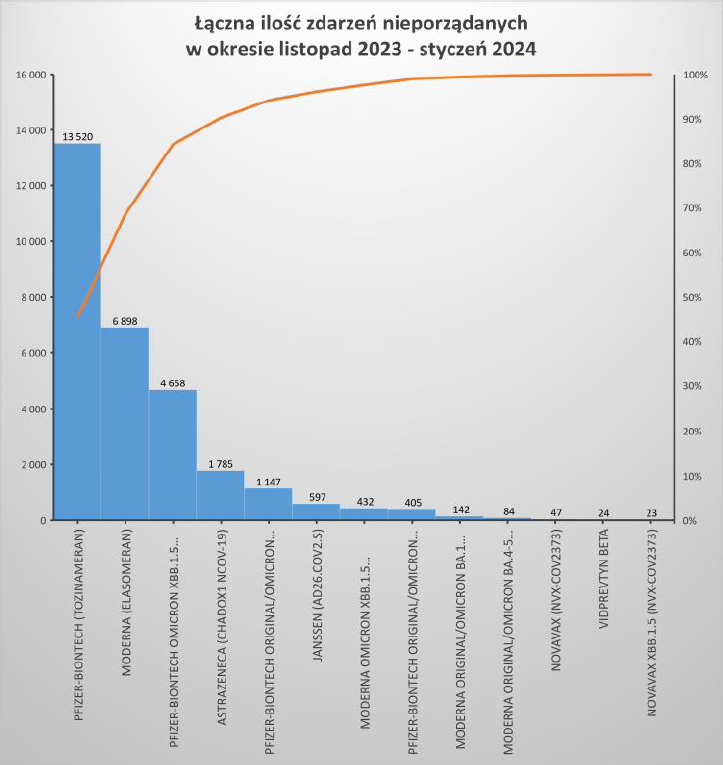
Źródło: https://www.adrreports.eu/pl/
- Top 7 PRZERAŻAJĄCYCH PRAWD, których CDC NIE chce, abyś poznał o “szczepionkach” i “dawkach przypominających” Covid-19
- Raporty dotyczące działań niepożądanych szczepionek przeciwko COVID-19 uzyskane z Europejskiej bazy danych
- Premier Słowacji łączy szczepionki przeciwko COVID-19 ze zgonami z przyczyn sercowo-naczyniowych
- Naukowcy apelują o globalne zawieszenie szczepień mRNA i natychmiastowe usunięcie ich z harmonogramu dla dzieci
- Badanie: Szczepionki przeciwko COVID-19 związane ze zwiększonym ryzykiem zakrzepów mózgu i udaru mózgu w połączeniu ze szczepionkami przeciwko grypie
- Badanie: Większość zgonów spowodowanych szczepionką Pfizer przeciwko COVID występuje w ciągu pierwszych 10 dni od wstrzyknięcia
- Nadmierna liczba zgonów wśród dzieci nadal rośnie w całej Europie po wprowadzeniu szczepionek przeciwko COVID-19 dla dzieci
- Naukowcy odkryli, że szczepionki przeciw COVID tworzą białka kolców w komórkach serca, powodując nieregularne skurcze serca i pełną kardiomiopatię
- Nowe badanie izraelskie pokazuje, że szczepienia przeciwko COVID zwiększają ryzyko śmierci
- Międzynarodowe czasopismo naukowe publikuje artykuł wzywający do zmiany klasyfikacji szczepionek mRNA przeciwko COVID-19 na terapie genowe
- Przemówienie w parlamencie brytyjskim o szczepionkach mRNA na COVID-19, które YouTube nie chciał pokazać
- Szczepionki mRNA przeciwko COVID-19 wiążą się z poważniejszymi szkodami, niż pierwotnie twierdzono