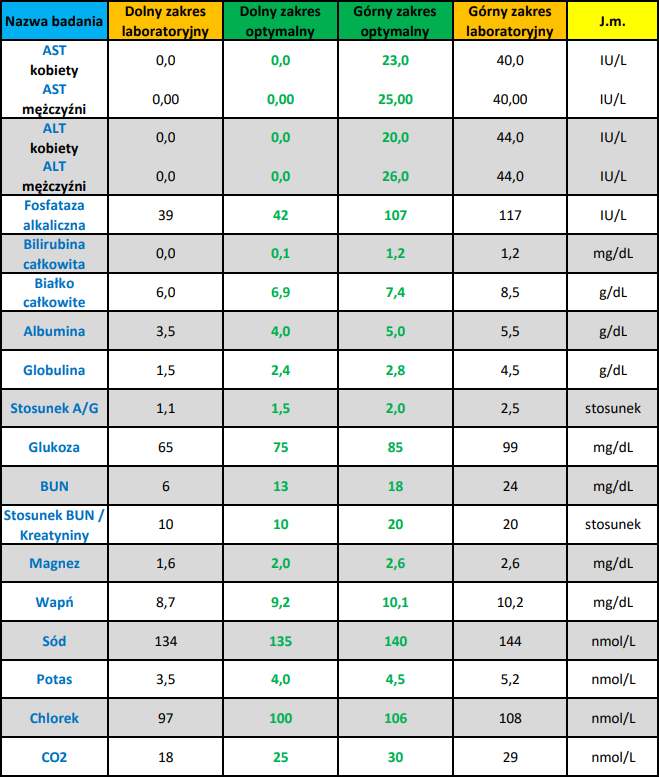
Interpretacja wyników badań
AST
ZAKRESY REFERENCYJNE DLA AST:
Laboratoryjny zakres referencyjny: 0-40 IU/L
Optymalny zakres referencyjny:[12]
- Mężczyźni: 0-25 IU/L
- Kobiety: 0-23 IU/L
OPIS:
Aminotransferaza asparaginianowa (AST) odwracalnie katalizuje przeniesienie grupy alfa-aminowej między asparaginianem i glutaminianem. W tej konwersji α-ketoglutaran jest również przekształcany w szczawiooctan. Podobnie jak w przypadku innych transaminaz, AST wymaga 5-fosforanu pirydoksalu (witaminy B6) jako kofaktora do katalizy, podczas gdy reakcja odwrotna wymaga 5′-fosforanu pirydoksaminy.[1] AST, znana również jako transaminaza glutaminowo-szczawiooctowa w surowicy (SGOT), katabolizuje aminokwasy, aby mogły one wejść w cykl kwasu cytrynowego i pomóc w produkcji energii.[2]
AST występuje w dwóch izozymach, jednym w cytozolu, a drugim w mitochondriach.[3],[4] Cytozolowa AST znajduje się w czerwonych krwinkach i tkance serca, podczas gdy mitochondrialna AST występuje w najwyższych stężeniach w wątrobie. AST znajduje się również w mięśniach szkieletowych, trzustce, śledzionie, płucach, nerkach i mózgu.[4] Ogólnie rzecz biorąc, łagodne uszkodzenie tkanki uwalnia AST z cytoplazmy, podczas gdy poważne uszkodzenie tkanki dodatkowo wylewa AST z mitochondriów do surowicy.[5] Obecnie nie ma podstaw klinicznych do rozróżnienia między cytozolową lub mitochondrialną AST w surowicy.[4]
Podwyższony poziom AST w surowicy występuje w każdej chorobie, która niszczy komórki wątroby (hepatocyty). Stopień podwyższenia poziomu AST może sugerować etiologię uszkodzenia wątroby. Przewlekłe choroby wątroby, takie jak marskość wątroby i przewlekłe zapalenie wątroby, powodują umiarkowany wzrost poziomu AST, około 5 do 10 razy powyżej górnej granicy normy.[2] Poziomy AST przekraczające 10-krotnie górną granicę referencyjną (wyraźne podwyższenie) zwykle wskazują na ostre uszkodzenie wątroby, takie jak niedokrwienie wątroby lub toksyczne uszkodzenie wątroby.[2] Poziomy aminotransferaz mogą przekraczać 75-krotność górnej granicy normy we wstrząsie wątrobowym spowodowanym przedawkowaniem leków hepatotoksycznych.
Łagodne podwyższenie AST często występuje w warunkach klinicznych.[2] Podwyższone AST może pochodzić ze źródeł pozawątrobowych, takich jak choroby serca, ale najczęściej odzwierciedla przewlekłe spożywanie alkoholu lub niealkoholowe stłuszczenie wątroby.[6] Łagodny nadmiar AST w surowicy może być spowodowany przewlekłym zapaleniem wątroby typu B, zapaleniem wątroby typu C, chorobą autoimmunologiczną, hemochromatozą lub nieprawidłowościami w metabolizmie miedzi (choroba Wilsona).[2] Ponieważ AST występuje w różnych tkankach innych niż wątroba, podwyższone AST niekoniecznie jest specyficzne dla uszkodzenia wątroby. Intensywny wysiłek fizyczny, uszkodzenie mięśni szkieletowych, uszkodzenie mięśnia sercowego (np. zawał mięśnia sercowego) lub ostre zapalenie trzustki mogą podnieść poziom AST w surowicy.
Z przyczyn, które nie są w pełni zrozumiałe, poziom AST jest obniżony u pacjentów z mocznicą i poddawanych hemodializie.[7],[8] Może to być związane z niedoborem witaminy B6.
AST jest mierzony w kontekście panelu funkcji wątroby i GGT.[9] ALT jest wyższy niż AST w większości chorób wątroby. Na przykład zakaźne zapalenie wątroby lub choroby zapalne wpływające na wątrobę podniosą ALT wyżej niż AST, sprawiając, że stosunek AST / ALT będzie mniejszy lub równy jeden.[5] I odwrotnie, alkoholowa choroba wątroby ogólnie podnosi poziom AST do dwukrotnie wyższego niż ALT w surowicy (tj. stosunek AST / ALT ≥2).[10] Marskość wątroby, ostra niedrożność dróg żółciowych i wczesne zapalenie wątroby podniosą AST bardziej niż ALT w surowicy.[11]
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[2]
- Intensywny wysiłek fizyczny
- Rabdomioliza
- Choroba wątroby prowadząca do uszkodzenia wątrobowokomórkowego
– Marskość wątroby
– Przewlekłe zapalenie wątroby
– Alkoholowa choroba wątroby
– Bezalkoholowa stłuszczeniowa choroba wątroby
– Autoimmunologiczne zapalenie wątroby
– Ostre wirusowe zapalenie wątroby
– Niedrożność dróg żółciowych
– Niedokrwienne uszkodzenie wątroby
– Rak wątroby - Uszkodzenie mięśnia sercowego (np. zawał mięśnia sercowego)
- Ostre zapalenie trzustki
- Leki (np. acetaminofen, halotan)
Obniżone poziomy:[7],[13]
- Niedobór witaminy B6
- Hemodializa
- Mocznica
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Zaburzenia metaboliczne (dysglikemia, insulinooporność itp.)
- Przeciążenie żelazem
- Bezalkoholowa stłuszczeniowa choroba wątroby
- Infekcje wirusowe
- Autoimmunologiczna choroba wątroby
Obniżone poziomy:
- Takie same jak konwencjonalne wskazania
- Upośledzona czynność wątroby
Odnośniki:
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3946379/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC545762/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC349441/
- http://www.ncbi.nlm.nih.gov/books/NBK425/
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8360
- http://www.ncbi.nlm.nih.gov/pubmed/12425538/
- http://www.ncbi.nlm.nih.gov/pubmed/8022112
- http://ndt.oxfordjournals.org/content/12/1/180.abstract
- http://dx.doi.org/10.1080/20014091084227
- http://www.ncbi.nlm.nih.gov/pubmed/2857631
- https://labtestsonline.org/understanding/analytes/ast/tab/test/
- http://www.ncbi.nlm.nih.gov/pubmed/21418268
- http://www.clinchem.org/content/20/9/1213.full.pdf
ALT
ZAKRESY REFERENCYJNE DLA ALT:
Laboratoryjny zakres referencyjny: 0-44 IU/L
Optymalne zakresy referencyjne:[18]
- Mężczyźni: 0-26 IU/L
- Kobiety: 0-20 IU/L
OPIS:
Aminotransferaza alaninowa (ALT), dawniej nazywana transaminazą glutaminianowo-pirogronianową w surowicy (SGPT),[1] jest enzymem występującym głównie w hepatocytach, który katalizuje przeniesienie grupy aminowej z alaniny na alfa-ketoglutaran, dając pirogronian i glutaminian. Poziom ALT w surowicy jest rutynowo mierzony w celu wykrycia i scharakteryzowania chorób wątroby.[2]
ALT jest czułym i dość specyficznym wskaźnikiem uszkodzenia komórek wątroby.[3] Podczas gdy najwyższa aktywność ALT występuje w wątrobie, mniejsze ilości można wykryć w mięśniach szkieletowych i nerkach.[4] ALT znajduje się wyłącznie w cytoplazmie i przedostaje się do krwiobiegu, gdy komórki są uszkodzone.[5] Tak więc praktycznie każda choroba, która niszczy hepatocyty, zwiększy poziom ALT w surowicy.[6] Aminotransferazy są usuwane z krążenia przez komórki sinusoidalne w wątrobie.[7] Podczas gdy okres półtrwania ALT w krążeniu wynosi około dwóch dni, masywne uszkodzenie wątroby może powodować długotrwałe podwyższenie ALT.[3]
Podwyższony poziom ALT w surowicy może pojawić się przed klinicznymi objawami choroby wątroby. Interpretując poziomy ALT w surowicy, ważne jest, aby stosować limity referencyjne dla wieku i płci; normalne wartości ALT u mężczyzn są o 25 do 30 procent wyższe niż u kobiet w tym samym wieku.[8],[9]
Stopień podwyższenia ALT we krwi może stanowić wskazówkę co do etiologii uszkodzenia wątroby. Przyczyny uszkodzenia wątroby od najwyższego do najniższego poziomu ALT w surowicy są następujące: niedokrwienne lub toksyczne uszkodzenie wątroby, ostre wirusowe zapalenie wątroby, autoimmunologiczne zapalenie wątroby, alkoholowa choroba wątroby, przewlekłe zapalenie wątroby i marskość wątroby.[7] Szybkość i stopień, w jakim ALT wzrasta, a następnie wraca do normy, również różni się w zależności od etiologii. Ostre niedokrwienne zapalenie wątroby powoduje bardzo wysoki wzrost ALT w surowicy ze stosunkowo szybkim powrotem do normy. Z drugiej strony, ostre wirusowe zapalenie wątroby wzrasta wolniej i zwykle nie osiąga takich samych poziomów, jak w przypadku ostrego niedokrwiennego zapalenia wątroby. Podobnie, poziomy ALT w surowicy powracają do normy stosunkowo wolno w ostrym wirusowym zapaleniu wątroby w porównaniu z niedokrwiennym uszkodzeniem wątroby.[7]
Poziomy aminotransferaz, w tym ALT, są nieprawidłowo niskie u pacjentów poddawanych hemodializie.[10] Jest to prawdopodobnie, ale niekoniecznie, spowodowane niedoborem witaminy B6.[11] Nieprawidłowo niskie poziomy ALT, w izolacji, zwykle nie są powodem do niepokoju.[3],[7]
ALT jest mierzona wraz z aminotransferazą asparaginianową (AST) jako część standardowego panelu funkcji wątroby.[12] Zbadanie stosunku AST do ALT może dostarczyć dodatkowych wskazówek na temat mechanizmu uszkodzenia wątroby. ALT jest wyższa niż AST w większości chorób wątroby, takich jak wirusowe lub autoimmunologiczne zapalenie wątroby.[13] Z drugiej strony, alkoholowa choroba wątroby, marskość wątroby, ostra niedrożność dróg żółciowych i wczesne zapalenie wątroby podnoszą AST bardziej niż ALT w surowicy.[14],[15] Transpeptydaza gamma-glutamylowa (GGT) jest również rutynowo mierzona wraz z ALT i może być lepsza niż poziomy AST i ALT w wykrywaniu nadużywania alkoholu lub alkoholowej choroby wątroby.[16],[17]
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[7],[19]
- Uszkodzenie mięśni (np. rabdomioliza)
- Hiperwitaminoza A
- Choroba wątroby prowadząca do uszkodzenia wątrobowokomórkowego
– Marskość wątroby
– Przewlekłe zapalenie wątroby
– Alkoholowa choroba wątroby
– Bezalkoholowa stłuszczeniowa choroba wątroby
– Autoimmunologiczne zapalenie wątroby
– Ostre wirusowe zapalenie wątroby
– Niedrożność dróg żółciowych
– Niedokrwienne uszkodzenie wątroby
– Rak wątroby - Uszkodzenie komórek nerkowych
- Hemoliza
- Leki i toksyny (np. acetaminofen, halotan, czterochlorek węgla, ołów)
Obniżone poziomy:[10],[11],[20]
- Niedobór witaminy B6
- Hemodializa
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Zaburzenia metaboliczne (dysglikemia, insulinooporność itp.)
- Przeciążenie żelazem
- Bezalkoholowa stłuszczeniowa choroba wątroby
- Infekcje wirusowe
- Autoimmunologiczna choroba wątroby
Obniżone poziomy:
- Takie same jak konwencjonalne wskazania
- Upośledzona czynność wątroby
Odnośniki:
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC438594/
- http://www.uptodate.com/contents/liver-biochemical-tests-that-detect-injury-to-hepatocytes
- http://ajcp.oxfordjournals.org/content/ajcpath/70/2/248.full.pdf
- http://www.ncbi.nlm.nih.gov/pubmed/13571034
- http://www.ncbi.nlm.nih.gov/pubmed/2686908/
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8362
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC545762/
- http://livertox.nih.gov/Atorvastatin.htm
- http://www.uptodate.com/contents/approach-to-the-patient-with-abnormal-liver-biochemical-and-function-tests
- http://www.ncbi.nlm.nih.gov/pubmed/8022112
- http://www.ncbi.nlm.nih.gov/pubmed/7554526
- https://www.nlm.nih.gov/medlineplus/ency/article/003436.htm
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8360
- https://www.ncbi.nlm.nih.gov/pubmed/2857631
- https://labtestsonline.org/understanding/analytes/ast/tab/test/
- http://dx.doi.org/10.1080/20014091084227
- http://www.uptodate.com/contents/enzymatic-measures-of-cholestasis-eg-alkaline-phosphatase-5-nucleotidase-gamma-glutamyl-transpeptidase
- http://www.ncbi.nlm.nih.gov/pubmed/21418268
- http://emedicine.medscape.com/article/2087247-overview#showall
- http://www.clinchem.org/content/20/9/1213.full.pdf
Fosfataza alkaliczna [ALP]
ZAKRESY REFERENCYJNE DLA FOSFATAZY ALKALICZNEJ:
Laboratoryjny zakres referencyjny: 39-117 IU/L
Optymalny zakres referencyjny: 42-107 IU/L
OPIS:
Fosfataza alkaliczna [ALP] odnosi się do rodziny pokrewnych metaloenzymów cynku obecnych w wątrobie, kościach, nerkach i łożysku.[1-3] Biologiczne znaczenie fosfatazy alkalicznej u ludzi jest w dużej mierze nieznane, chociaż enzym wydaje się odgrywać rolę w mineralizacji kości i wchłanianiu tłuszczu.[4-6] Podczas gdy funkcja enzymatyczna fosfatazy alkalicznej ma stosunkowo niewielkie znaczenie kliniczne, poziom fosfatazy alkalicznej we krwi jest ważnym biomarkerem choroby.[4]
Poziom fosfatazy alkalicznej w surowicy wzrasta głównie w jednej z dwóch sytuacji, albo z powodu zastoju żółci, albo zwiększonej aktywności osteoblastycznej w kościach.[3] W obu przypadkach ekspresja fosfatazy alkalicznej w odpowiednich tkankach jest stymulowana przez pewne zdarzenie inicjujące. W chorobach wątroby i dróg żółciowych biosynteza fosfatazy alkalicznej w surowicy jest stymulowana przez kwasy żółciowe zatrzymane w układzie wątrobowo-żółciowym.[7],[8] Zwiększona synteza oraz zniszczenie komórek wątroby w następstwie choroby wątroby i dróg żółciowych prowadzi do regurgitacji i wycieku fosfatazy alkalicznej do krwi, co jest wykrywane za pomocą testów laboratoryjnych.
W chorobach kości aktywność fosfatazy alkalicznej jest stymulowana przez zwiększoną aktywność osteoblastów. W rzeczywistości fosfataza alkaliczna jest głównym glikozylowanym białkiem występującym w kościach, gdzie jest związana z powierzchnią komórek osteoblastów.[9] Normalne procesy fizjologiczne lub choroby, które stymulują wzrost kości, odruchowo zwiększają aktywność osteoblastów, a tym samym aktywność fosfatazy alkalicznej. Ponieważ poziomy fosfatazy alkalicznej różnią się w zależności od aktywności osteoblastycznej, poziomy enzymu są na ogół wyższe u dzieci i młodzieży, ponieważ są to okresy szybkiego wzrostu kości.[4] Ponadto choroby, które powodują zwiększony obrót kostny, takie jak choroba Pageta, mogą zwiększać poziomy fosfatazy alkalicznej we krwi.[10]
Podwyższone poziomy fosfatazy alkalicznej są również odnotowywane w innych stanach niechorobowych.[11] Poziomy fosfatazy alkalicznej mogą również wzrosnąć w mniejszym stopniu w trzecim trymestrze normalnej ciąży. Wzrost ten jest prawdopodobnie spowodowany napływem łożyskowej fosfatazy alkalicznej do surowicy.[4] Co ciekawe, osoby z grupami krwi O lub B mogą mieć przejściowe podwyższenie poziomu fosfatazy alkalicznej w surowicy po spożyciu tłustego posiłku.[4],[11] Niezależnie od źródła tkankowego, fosfataza alkaliczna jest usuwana z surowicy w stałym tempie, niezależnie od czynności wątroby lub stanu dróg żółciowych.[12] Jej okres półtrwania w surowicy wynosi siedem dni.[13]
Podwyższony poziom fosfatazy alkalicznej w surowicy jest zwykle bardziej palącym problemem klinicznym niż nieprawidłowo niski poziom.[14] Niemniej jednak kilka procesów chorobowych może obniżyć poziom fosfatazy alkalicznej w surowicy poniżej normalnego zakresu. Zmniejszona aktywność fosfatazy alkalicznej w surowicy występuje u ponad 50% pacjentów, którzy przeszli operację kardiochirurgiczną wymagającą zastosowania pompy omijającej serce.[14] Może to być przynajmniej częściowo spowodowane niedoborem magnezu, ponieważ niedobór tego pierwiastka może bezpośrednio obniżać poziom fosfatazy alkalicznej.[15] Niedobór cynku jest prawdopodobnie najbardziej znaną przyczyną niskiego poziomu fosfatazy alkalicznej, chociaż może to nie być powszechna przyczyna w krajach zachodnich.[14] Niedokrwistość i różne zaburzenia endokrynologiczne mogą obniżać poziom fosfatazy alkalicznej w surowicy.
Fosfataza alkaliczna jest jednym z podstawowych pomiarów w standardowym panelu wątrobowym, który obejmuje również aminotransferazę alaninową (ALT), aminotransferazę octanową (AST), bilirubinę, albuminę i białko całkowite.[16] Transpeptydaza gamma-glutamylowa (GGT) może być zlecona w celu potwierdzenia, że podwyższony poziom fosfatazy alkalicznej pochodzi ze źródła wątrobowo-żółciowego.[12] Poziomy GGT korelują z poziomami fosfatazy alkalicznej w chorobach wątroby i dróg żółciowych (tj. oba są podwyższone).[17] Fosfataza alkaliczna specyficzna dla kości może być stosowana do monitorowania leczenia u osób z chorobą Pageta, osteoporozą lub osteomalacją.[18]
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[11]
- Ciąża (normalna w trzecim trymestrze)
- Choroby endokrynologiczne
– Nadczynność tarczycy
– Nadczynność przytarczyc - Cholestaza wątrobowa
- Cholestaza żółciowa
- Choroby kości
– Niedobór witaminy D
– Krzywica
– Gojenie się złamań kości
– Choroba Pageta
– Osteomalacja
– Nowotwory złośliwe kości - Tłusty posiłek (tylko grupy krwi B i O)
- Leki
– Estrogeny
– Androgeny
– Albumina
– Fenotiazyny
– Erytromycyna
– Doustne leki hipoglikemizujące
Obniżone poziomy:[11],[14],[15],[19],[20]
- Ciężka niedokrwistość
- Niedokrwistość złośliwa
- Niedożywienie
- Brak równowagi składników odżywczych
– Niedobór fosforanów
– Niedobór cynku
– Niedobór magnezu
– Niedobór witaminy C
– Hiperwitaminoza D - Choroba Wilsona
- Niedoczynność tarczycy
- Niedoczynność przytarczyc
- Celiakia
- Estrogenowa terapia zastępcza
- Operacje kardiochirurgiczne (zwłaszcza z użyciem pompy bypass)
- Transfuzje krwi o dużej objętości
- Zespół mleczno-alkaliczny
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Takie same jak wskazania konwencjonalne
Obniżone poziomy:
- Takie same jak wskazania konwencjonalne oraz:
- Niedobór kwasu foliowego
- Niedobór witaminy B6
Odnośniki:
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC391871/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC349504/
- http://www.ncbi.nlm.nih.gov/pubmed/6751596
- http://www.uptodate.com/contents/approach-to-the-patient-with-abnormal-liver-biochemical-and-function-tests
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2254479/
- http://press.endocrine.org/doi/abs/10.1210/edrv-15-4-439
- http://www.ncbi.nlm.nih.gov/pubmed?term=3710439
- http://www.ncbi.nlm.nih.gov/pubmed?term=488632
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3152283/
- http://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-paget-disease-of-bone
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3341633/
- http://www.uptodate.com/contents/enzymatic-measures-of-cholestasis-eg-alkaline-phosphatase-5-nucleotidase-gamma-glutamyl-transpeptidase
- http://www.ncbi.nlm.nih.gov/pubmed?term=5835974
- http://www.clinchem.org/content/41/4/515.abstract
- http://www.ncbi.nlm.nih.gov/pubmed/6189394
- https://labtestsonline.org/understanding/analytes/liver-panel/tab/test/
- http://ajcp.oxfordjournals.org/content/ajcpath/60/5/672.full.pdf
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/82985
- https://labtestsonline.org/understanding/analytes/alp/tab/test/
- http://www.clinchem.org/content/35/4/664.abstract
Bilirubina całkowita
ZAKRESY REFERENCYJNE DLA BILIRUBINY CAŁKOWITEJ:
Laboratoryjny zakres referencyjny: 0-1,2 mg/dL
Optymalny zakres referencyjny: 0,1-1,2 mg/dL
OPIS:
Bilirubina jest produktem odpadowym katabolizmu hemu.[1] Bilirubina może znajdować się w krwiobiegu, w wątrobie, w żółci lub w jelitach, gdy przechodzi od produktu ubocznego degradacji czerwonych krwinek do ostatecznej eliminacji z kałem.[1] W stężeniach fizjologicznych bilirubina może służyć jako przeciwutleniacz.[2] Co więcej, ta pigmentowana cząsteczka jest odpowiedzialna za charakterystyczny kolor żółci i kału.[3],[4] Jednak podwyższony poziom bilirubiny może być toksyczny dla komórek i organelli wewnątrzkomórkowych.[1],[5] Znacznie podwyższone stężenie bilirubiny w surowicy u noworodków może powodować zaburzenia neurologiczne, a nawet śmierć.[6],[7]
Około 80% bilirubiny pochodzi z hemoglobiny, a pozostałe 20% z innych cząsteczek zawierających hem, w tym mioglobiny, cytochromów, katalazy i peroksydazy.[1] Hem jest przekształcany w biliwerdynę przez oksygenazę hemową, która jest następnie przekształcana w bilirubinę przez reduktazę biliwerdyny.[9]
Poziom bilirubiny jest kontrolowany przez złożone mechanizmy fizjologiczne, które zapobiegają osiągnięciu przez bilirubinę poziomu toksycznego w normalnych warunkach.[1],[8] Mechanizmy te obejmują wychwyt i magazynowanie w wątrobie, koniugację z kwasem glukuronowym, wiązanie z białkami surowicy i degradację enzymatyczną w przewodzie pokarmowym.[1]
Bilirubina jest dość nierozpuszczalna w wodzie, więc zwykle jest przenoszona przez albuminy we krwi. Kompleks bilirubina-albumina transportuje bilirubinę do wątroby, gdzie jest ona pobierana przez hepatocyty.[1] W komórkach wątroby bilirubina jest sprzęgana z glukuronidem, dzięki czemu staje się rozpuszczalna w wodzie.[10] Sprzężona bilirubina jest następnie wydalana do żółci. Bakterie w jelitach dalej metabolizują sprzężoną bilirubinę do urobilinogenów, które są ponownie wchłaniane przez jelito kręte i jelito grube (20%) lub wydalane z kałem (80%). Ponownie wchłonięty urobilinogen jest metabolizowany przez wątrobę i ponownie wydalany z żółcią lub wydalany z moczem. Gdy ten układ wydalniczy jest dysfunkcyjny, nerki mogą wydalać od 50 do 90 procent bilirubiny sprzężonej.[11]
Jak sama nazwa wskazuje, bilirubina całkowita stanowi miarę wszystkich cząsteczek bilirubiny w surowicy. Obejmuje to zarówno sprzężone, jak i niesprzężone formy bilirubiny. Nieskoniugowana bilirubina jest bardzo słabo rozpuszczalna w wodzie i musi być związana z białkami we krwi. Nieskoniugowana bilirubina wiąże się z albuminami i, w mniejszym stopniu, z lipoproteinami, gdy jest wydzielana przez wątrobę.[1] W normalnych warunkach bardzo niewielka ilość niesprzężonej bilirubiny jest wolna (tj. niezwiązana z białkami) we krwi. Niemniej jednak, nadmierne ilości bilirubiny niesprzężonej mogą przekroczyć zdolność wiązania albuminy i krążyć swobodnie we krwi. Wszystkie znane toksyczne działania bilirubiny są związane z podwyższonym stężeniem formy niesprzężonej.[1]
Laboratoria mogą zgłaszać bilirubinę bezpośrednią i pośrednią zamiast bilirubiny sprzężonej i niesprzężonej. Bilirubina bezpośrednia jest miarą rozpuszczalnych w wodzie form bilirubiny i jest zasadniczo równoważna bilirubinie sprzężonej w próbce.[12] Bilirubina całkowita minus bilirubina bezpośrednia daje bilirubinę pośrednią (tj. bilirubinę niesprzężoną).
Etiologię podwyższonego stężenia bilirubiny całkowitej (hiperbilirubinemii) można zrozumieć na podstawie tego, czy bilirubina nagromadziła się przed czy po koniugacji. Nieskoniugowana hiperbilirubinemia jest spowodowana zwiększoną produkcją bilirubiny, upośledzonym wątrobowym wychwytem bilirubiny lub upośledzoną koniugacją bilirubiny.[13],[14] Z drugiej strony, sprzężona hiperbilirubinemia jest spowodowana cholestazą pozawątrobową (tj. niedrożnością dróg żółciowych) lub cholestazą wewnątrzwątrobową. Podwyższony poziom bilirubiny całkowitej jest zwykle spowodowany podwyższonym poziomem bilirubiny niesprzężonej (tj. bilirubiny bezpośredniej).[12] Prawie u każdego noworodka poziom bilirubiny w osoczu/surowicy przekracza normalny poziom u dorosłych, choć niewiele noworodków doświadcza problemów klinicznych związanych z toksycznym działaniem bilirubiny. Ciężka hiperbilirubinemia noworodków może jednak powodować długotrwałe powikłania neurologiczne i śmierć.
Niewiele pracy wykonano w celu zbadania przyczyn niskiego stężenia bilirubiny całkowitej w surowicy. Jednak poziom bilirubiny może być obniżony u pacjentów z zespołem nerczycowym w kontekście uogólnionej utraty białka w moczu.[15] Cząsteczka może być również wskaźnikiem prognostycznym dla innych stanów, takich jak albuminuria w cukrzycy typu 2 lub przewlekłej chorobie nerek.[16],[17]
Bilirubina jest jednym z sześciu składników standardowego panelu wątrobowego, który obejmuje aminotransferazę alaninową (ALT), aminotransferazę octanową (AST), fosfatazę alkaliczną, albuminy i białko całkowite.[18]
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[13],[14]
- Nieskoniugowana hiperbilirubinemia
– Zwiększona produkcja bilirubiny (np. hemoliza, wynaczynienie krwi)
– Upośledzony wychwyt bilirubiny przez wątrobę
– Niewydolność serca
– Przeciek portosystemowy
– Leki (np. ryfampina, probenecyd)
– Upośledzona koniugacja bilirubiny
– Zespół Criglera-Najjara typu I i II
– Zespół Gilberta (najczęstsza przyczyna podwyższenia stężenia bilirubiny)
– Noworodki (normalne u większości noworodków, bardzo wysokie poziomy mogą być niebezpieczne)
– Nadczynność tarczycy
– Przewlekła choroba wątroby
– Etynyloestradiol
– Hiperbilirubinemia sprzężona
– Cholestaza pozawątrobowa
– Atrezja dróg żółciowych
– Kamica żółciowa
– Nowotwór (np. rak dróg żółciowych)
– Pierwotne stwardniające zapalenie dróg żółciowych
– Cholangiopatia AIDS
– Ostre i przewlekłe zapalenie trzustki
– Pasożyty (np. Ascaris lumbricoides, przywry wątrobowe)
– Wewnątrzwątrobowa cholestaza
– Zapalenie wątroby (np. wirusowe, alkoholowe, niealkoholowe, noworodkowe)
– Pierwotne żółciowe zapalenie dróg żółciowych
– Leki/toksyny (np. alkilowane steroidy, chlorpromazyna, arsen)
– Sepsa
– Wstrząs
– Choroby naciekowe (np. amyloidoza, chłoniak, sarkoidoza)
– Całkowite żywienie pozajelitowe
– Cholestaza pooperacyjna
– Przełom wątrobowy w niedokrwistości sierpowatokrwinkowej
Obniżone poziomy:[15]
- Zespół nerczycowy
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Takie same jak wskazania konwencjonalne
Obniżone poziomy:
- Takie same jak wskazania konwencjonalne
Odnośniki:
- http://www.uptodate.com/contents/bilirubin-metabolism
- http://science.sciencemag.org/content/sci/235/4792/1043.full.pdf
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3801310/
- https://labtestsonline.org/understanding/analytes/bilirubin/tab/sample/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4269762/
- http://www.ncbi.nlm.nih.gov/pubmed?term=16765731
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4388741/
- http://www.ncbi.nlm.nih.gov/pubmed/20954156
- http://www.uptodate.com/contents/image?imageKey=GAST/65197&topicKey=GAST%2F3622&source=outline_link&search=bilirubin&selectedTitle=3%7E150&utdPopup=true
- http://www.ncbi.nlm.nih.gov/pubmed/2156293
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1476873/
- https://labtestsonline.org/understanding/analytes/bilirubin/tab/test/
- http://www.uptodate.com/contents/image?imageKey=GAST/55607&topicKey=GAST%2F3615&source=outline_link&search=hyperbilirubinemia&selectedTitle=2%7E150&utdPopup=true
- http://www.uptodate.com/contents/classification-and-causes-of-jaundice-or-asymptomatic-hyperbilirubinemia
- http://www.ncbi.nlm.nih.gov/pubmed/24615116
- http://www.ncbi.nlm.nih.gov/pubmed/24332706
- http://www.ncbi.nlm.nih.gov/pubmed/24763407
- https://labtestsonline.org/understanding/analytes/liver-panel/tab/test/
Białko całkowite
ZAKRESY REFERENCYJNE DLA BIAŁKA CAŁKOWITEGO:
Laboratoryjny zakres odniesienia: 6–8,5 g/dl
Optymalny zakres odniesienia: 6,9–7,4 g/dl
OPIS:
Białko całkowite to ilość krążących białek na jednostkę objętości surowicy. Krew zawiera wiele krążących białek, ale można je podzielić na dwie główne klasy: albuminy i globuliny.[1] Albumina surowicy stanowi 60 procent całkowitego białka, a globuliny surowicy stanowią pozostałe 40 procent.[2] Globuliny obejmują między innymi immunoglobuliny (tj. przeciwciała), czynniki krzepnięcia, enzymy i hormony peptydowe.[1],[2] Białka osocza pełnią szereg krytycznych funkcji we krwi, takich jak zapewnienie ciśnienia osmotycznego w celu utrzymania równowagi płynów między naczyniami a tkankami. suszenie małych cząsteczek i jonów oraz działanie jako repozytorium aminokwasów dla tkanek.[2]
Albumina i większość białek globulinowych są syntetyzowane w wątrobie.[3] Ważnym wyjątkiem są immunoglobuliny, które są syntetyzowane przez komórki jednojądrzaste w szpiku kostnym, węzłach chłonnych i śledzionie.[4] Wątroba jest zdolna do syntezy wszystkich aminokwasów z wyjątkiem tak zwanych aminokwasów egzogennych, które muszą być spożywane w diecie. Synteza ta zakłada jednak, że wątroba ma stałą dostawę pokarmowych protein dla biosyntezy reakcji. W zdrowych jednostkach tempo proteinowa synteza z grubsza równa tempo przy którym proteina używa, katabolized komórkami lub excreted. Zatem całkowite poziomy białka w surowicy są względnie stabilne.[2]
Całkowity proteinowy pomiar jest stosunkowo niedrogim sposobem ilościowo określać albuminy i globuliny we krwi. Najwięcej nowożytni laboratoria używają prostego colorimetric assay wykrywać proteinowe poziomy. Dwuwartościowa miedź reaguje z wiązaniami peptydowymi w białkach tworząc purpurowy kompleks biuretu.[1],[5] Co ważne, reakcja ta wykrywa wszystkie wiązania peptydowe, więc całkowite białko nie może odróżnić albuminy od poszczególnych typów globulin.[1] Ponieważ albumina stanowi około 60 procent całkowitego białka w surowicy, zmniejszenie stężenia albumin może być wystarczające do zmniejszenia całkowitej ilości białka bez zmiany innych poziomów białek w surowicy.[2],[4] Wymagane są dodatkowe badania w celu określenia nieprawidłowości w poszczególnych białkach surowicy.
Hiperproteinemia jest nienormalnie wysokim poziomem białek we krwi. Prawie wszystkie przypadki hiperproteinemii można wyjaśnić jedną z dwóch przyczyn: albo całkowita ilość wody w osoczu jest nienormalnie mała, co powoduje hemokoncentrację, albo szybkość syntezy białek jest nienormalnie wysoka (np. stan zapalny, gammopatia monoklonalna).[2],[4],[6] Podwyższony poziom białka całkowitego powinien być brany pod uwagę w kontekście odwodnienia, albo z powodu braku przyjmowania wody lub nadmiernej utraty wody. W przypadku braku odwodnienia należy wziąć pod uwagę procesy zapalne lub nowotwór hematologiczny. Testy dla poliklonalnych i monoklonalnych immunoglobulin mogą pomagać odróżniać były od ten ostatni.
Nieprawidłowo niski całkowity poziom białka w surowicy nazywany jest hipoproteinemią. Hemodylucja lub względna obfitość wody w osoczu może powodować względną hipoproteinemię. Hemodylucja często występuje po dożylnym podaniu płynów i w zaawansowanej zastoinowej niewydolności serca, ale może również wystąpić w polidypsji.[7-9] Oprócz hemodylucji, hipoproteinemia jest spowodowana zmniejszoną produkcją białka lub zwiększoną utratą białka. Zmniejszona proteinowa produkcja może być należna proteinowy niedożywienie który pozbawia wątrobę amino kwasy i peptides wymagać dla biosynthetic drogi przemian. Choroba wątroby może wynikać w zmniejszonej syntezie białek nawet w kontekście odpowiedniego proteinowego naboru. Podczas gdy zdrowe nerki nie wydalają białek osocza, osoby z zespołem nerczycowym mogą doświadczać znacznego marnowania białka w moczu, co może prowadzić do hipoproteinemii.[3],[10]
Całkowite białko jest praktycznie zawsze mierzone jako część panelu wątrobowego, który obejmuje również aminotransferazę alaninową (ALT), aminotransferazę octanową (AST), fosfatazę alkaliczną, bilirubinę i albuminę. Ponieważ hemodylucja i hemokoncentracja mogą bezpośrednio wpływać na interpretację całkowitego białka w surowicy, w celu uzyskania pomiarów azotu mocznikowego we krwi (BUN) i kreatyniny zleca się również podstawowy lub kompletny panel metaboliczny.[2]
PATOLOGICZNE/KONWENCJONALNE WSKAZANIA:
Podwyższone poziomy:[3],[4],[6]
- Hemokoncentracja
– Niewystarczające ujęcie wody
– Nadmierna diureza - Ostre zapalenie
- Ostre zakażenie
- HIV/AIDS
- Amyloidoza
- Nowotwór hematologiczny
– Szpiczak mnogi
– Gammopatia monoklonalna
– Chłoniak
– Białaczka
– Makroglobulinemia (np. makroglobulinemia Waldenströma)
Obniżone poziomy:[3],[7-9],[12]
- Hemodylucja
– Nadmierne podanie płynów dożylnych
– Zaawansowana zastoinowa niewydolność serca
– Polidypsja
– Niedożywienie białkowe - Niedożywienie białkowe
- Zaawansowana choroba wątroby
- Niewydolność nerek
- Zespół nerczycowy
- Enteropatia z utratą białka
– Pierwotne choroby błony śluzowej przewodu pokarmowego (np. wrzodziejące zapalenie jelita grubego)
– Zwiększone ciśnienie śródmiąższowe lub niedrożność limfatyczna (np. sarkoidoza)
– Nieerozyjne choroby górnego odcinka przewodu pokarmowego (np. celiakia sprue) - Hipogammaglobulinemia
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Hipochlorhydria
- Dna moczanowa
Obniżone poziomy:
- Zaburzenia wchłaniania białek (z powodu hipochlorhydrii lub zaburzenia czynności wątroby)
Odnośniki:
- http://www.medscape.com/viewarticle/823421_4
- https://labtestsonline.org/understanding/analytes/tp/tab/sample/
- http://www.medscape.com/viewarticle/823421_6
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8520
- http://www.mayomedicallaboratories.com/test-catalog/Performance/8520
- http://www.uptodate.com/contents/recognition-of-monoclonal-proteins
- http://circ.ahajournals.org/content/107/2/226.abstract
- http://www.sciencedirect.com/science/article/pii/0031938476900123
- http://dx.doi.org/10.1016/S0952-8180(98)00034-8
- http://www.uptodate.com/contents/overview-of-heavy-proteinuria-and-the-nephrotic-syndrome
- https://labtestsonline.org/understanding/analytes/liver-panel/tab/test/
- http://emedicine.medscape.com/article/182565-overview#showall
Albumina
ZAKRESY REFERENCYJNE DLA ALBUMINY:
Laboratoryjny zakres referencyjny: 3,5-5,5 g/dL
Optymalny zakres referencyjny: 4-5 g/dL
OPIS:
Albumina jest najobficiej występującym białkiem we krwi. Składa się z około 60 procent białek w osoczu.[1] Albumina przyczynia się do ciśnienia osmotycznego w naczyniach krwionośnych, co jest ważne dla równowagi płynów w tkankach obwodowych.[2] Białko osocza działa jako nośnik różnych cząsteczek, w tym wapnia, niesprzężonej bilirubiny, hormonów tarczycy, długołańcuchowych kwasów tłuszczowych, toksycznych jonów metali ciężkich i wielu leków.[2],[3]
Albumina jest syntetyzowana przez wątrobę.[2] Biosynteza albuminy wymaga wystarczającej ilości niezbędnych aminokwasów (tj. histydyny, leucyny, izoleucyny, lizyny, fenyloalaniny, metioniny, treoniny, tryptofanu i waliny).[4] U zdrowych osób szybkość syntezy albuminy jest w przybliżeniu równa szybkości, z jaką białko jest wykorzystywane, katabolizowane lub wydalane.[1] W porównaniu z innymi białkami, albumina ma stosunkowo długi okres półtrwania i pozostaje względnie stała.[2] Wewnątrznaczyniowy okres półtrwania albuminy wynosi 16 godzin, ale okres półtrwania w tkankach wynosi 19 dni.[5-7]
Poziom albuminy jest względnie stały, nawet we wczesnych fazach niedoboru żywieniowego lub choroby wątroby. Dlatego marker surowicy nie jest czułym wskaźnikiem tych stanów. Białka prealbuminy, takie jak transtyretyna, białko wiążące retinol i czynniki krzepnięcia, mają krótszy okres półtrwania i szybciej zwiastują początek zaburzeń odżywiania lub biosyntezy.[2] Niski poziom albuminy w surowicy silnie koreluje z zachorowalnością i śmiertelnością; każde 10 g / l spadku albuminy w surowicy wiąże się ze 137-procentowym wzrostem ryzyka zgonu i 89-procentowym wzrostem ryzyka zachorowalności.[5]
Hiperalbuminemia, czyli nieprawidłowe podwyższenie stężenia albuminy we krwi, zazwyczaj odzwierciedla odwodnienie i hemokoncentrację.[8] Łagodne podwyższenie stężenia albuminy może być spowodowane dietą wysokobiałkową, choć kliniczne konsekwencje tego są znikome.9 Rak wątrobowokomórkowy może teoretycznie stymulować syntezę albuminy, powodując podwyższone poziomy w surowicy, ale jest to niezwykle rzadkie.[10]
Znacznie częściej poziom albumin jest nieprawidłowo niski (tj. hipoalbuminemia). Hipoalbuminemia może być spowodowana rozcieńczeniem w wyniku względnego wzrostu płynów wewnątrznaczyniowych. Niskie poziomy albuminy w surowicy zwykle wskazują na upośledzoną biosyntezę w wątrobie, niewystarczające spożycie białka, zwiększony katabolizm białka w tkankach, upośledzone wchłanianie białka lub utratę białka z wydalania przez nerki.[3] Poziom albuminy może być nienormalnie niski u pacjentów z ostrym stanem zapalnym, wstrząsem lub enteropatią powodującą utratę białka.[8] Niezwykle rzadki autosomalny recesywny stan zwany analbuminemią powoduje całkowity brak krążącej albuminy.[11] Co ciekawe, stan ten zwykle nie powoduje nic poważniejszego niż obrzęk.[2],[11]
Albumina jest standardowym składnikiem panelu wątrobowego, który obejmuje aminotransferazę alaninową (ALT), aminotransferazę octanową (AST), fosfatazę alkaliczną, bilirubinę i białko całkowite.[12]
PATOLOGICZNY/KONWENCJONALNY ZAKRES WSKAZAŃ:
Podwyższone poziomy:[8-10]
- Hemokoncentracja
– Nieodpowiednie spożycie wody
– Nadmierna diureza - Dieta wysokobiałkowa z suplementacją białka (rzadko)
- Rak wątrobowokomórkowy (rzadko)
Obniżone poziomy:[2],[13-16]
- Hemodylucja
– Płyny podawane dożylnie
– Zaawansowana zastoinowa niewydolność serca
– Polidypsja - Niedożywienie białkowe
- Zespół złego wchłaniania białka
- Niewydolność wątroby
- Zaawansowana choroba wątroby
- Niewydolność nerek
- Zespół nerczycowy
- Zapalenie
- Enteropatia z utratą białka
– Pierwotne choroby błony śluzowej przewodu pokarmowego (np. wrzodziejące zapalenie jelita grubego)
– Zwiększone ciśnienie śródmiąższowe lub niedrożność limfatyczna (np. sarkoidoza)
– Nieerozyjne choroby górnego odcinka przewodu pokarmowego (np. celiakia) - Analbuminemia
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Odwodnienie (hematokryt, hemoglobina i czerwone krwinki będą również często podwyższone w zakresie funkcjonalnym).
Obniżone poziomy:
- Upośledzona czynność wątroby
- Zapalenie
Odnośniki:
- https://labtestsonline.org/understanding/analytes/tp/tab/sample/
- http://www.medscape.com/viewarticle/823421_6
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8436
- http://www.medscape.com/viewarticle/823421_3
- http://emedicine.medscape.com/article/166724-overview#showall
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4036356/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2193842/
- https://labtestsonline.org/understanding/analytes/albumin/tab/test/
- http://www.ncbi.nlm.nih.gov/pubmed/16716979
- http://www.ncbi.nlm.nih.gov/pubmed/19473332
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC44823/
- https://labtestsonline.org/understanding/analytes/liver-panel/tab/test/
- http://dx.doi.org/10.1016/S0952-8180(98)00034-8
- http://www.sciencedirect.com/science/article/pii/0031938476900123
- http://circ.ahajournals.org/content/107/2/226.abstract
- http://emedicine.medscape.com/article/182565-overview#showall
Globulina
ZAKRESY REFERENCYJNE DLA GLOBULINY:
Laboratoryjny zakres odniesienia: 1,5–4,5 g/dL
Optymalny zakres odniesienia: 2,4–2,8 g/dL
OPIS:
W kontekście laboratoryjnej oceny i biomarkers, globuliny są dowolnymi białkami osocza innymi niż albumina. Globuliny stanowią 40% białek osocza i obejmują białka nośnikowe, enzymy, dopełniacze, czynniki krzepnięcia i immunoglobuliny.[1-3] Globuliny odgrywają wiele różnych fizjologicznych ról w organizmie w zależności od typu. Immunoglobuliny i dopełniacz bawić się znacząco rola w adaptacyjnych i wrodzonych systemach odpornościowych, na przykład. Z wyjątkiem immunoglobulin, praktycznie wszystkie globuliny są syntetyzowane w wątrobie.[4]
Krążące immunoglobuliny (tj. przeciwciała), w przeciwieństwie do immunoglobulin związanych z błoną, są wytwarzane głównie przez aktywowane komórki osocza.[5],[6] Ich produkcja jest stymulowana przez ekspozycję na antygeny. Po ekspozycji na antygen, przeciwciała są umieszczane w komórkach pamięci B, które są długowiecznymi komórkami, które mogą szybko reagować na przyszłe prowokacje antygenami.[6] Wykluczając chorobę układu odpornościowego, dodatkowa ekspozycja na antygen powoduje krótkotrwały i stosunkowo intensywny wzrost krążących immunoglobulin. Inne krążące globuliny utrzymują się przy raczej stałymi poziomami we krwi w normalnych warunkach, zrównoważone pomiędzy syntezą i degradacją, wykorzystaniem i wydalaniem.
Surowi globuliny są zazwyczaj szacowane od innych bezpośrednio mierzonych substancji na wątrobowym panelu, mianowicie całkowita proteina i albumina. Ponieważ krążącymi białkami osocza są albo albuminy, albo globuliny, poziom globuliny w surowicy jest szacowany przez odjęcie albuminy od białka całkowitego.[3] Podczas gdy podwyższone poziomy globulin mogą być widoczne na podstawie tych obliczeń na podstawie zmierzonych wartości, obniżone poziomy globulin mogą być mniej widoczne, zwłaszcza gdy występują niedobory stosunkowo niewielkich globulin.
Serum proteiny mogą dalej oddzielający elektroforeza który oddziela albuminę od globulin. Frakcje globulin migrują do czterech pasm na żelu elektroforezy: α1, α2, β i Ή.1,3Immunoglobuliny mają tendencję do migracji i skupisk w pasmie Ή podczas elektroforezy i jako takie są czasami określane jako gamma globuliny.[1] Podwyższone poziomy immunoglobulin można dodatkowo scharakteryzować za pomocą immunoelektroforezy, ustalając, czy wzrost składa się z jednego typu immunoglobuliny (tj. monoklonalnej) czy kilku typów (tj. poliklonalnej).[3]
Podwyższone stężenia globulin w surowicy na ogół odzwierciedlają nadprodukcję. Na przykład szpiczak mnogi jest nowotworową proliferacją komórek plazmatycznych, która powoduje znaczne podwyższenie poziomu immunoglobuliny monoklonalnej.[7] Choroby autoimmunologiczne mogą również zwiększać poziom krążących globulin.[2] Podobnie ostre zapalenie może powodować przemijający wzrost poziomu globulin w surowicy. Hemokoncentracja lub względny brak wody wewnątrznaczyniowej może prowadzić do względnej hiperglobulinemii.
Obniżony poziom globulin jest zazwyczaj wynikiem niedostatecznej produkcji immunoglobulin.[2] Może to być spowodowane nieprawidłowościami genetycznymi (np. agammaglobulinemia sprzężona z chromosomem X) lub nowotworami złośliwymi układu krwiotwórczego (przewlekła białaczka limfocytowa). U noworodków w ciągu pierwszych sześciu miesięcy życia występuje normalny okres hipogammaglobulinemii; jednak poważne niedobory gamma globulin lub przedłużająca się hipogammaglobulinemia są nienormalne.[8]
PATOLOGICZNE/KONWENCJONALNE WSKAZANIA:
Podwyższone poziomy:[4],[9],[10]
- Hemokoncentracja
– Niewystarczające ujęcie wody
– Nadmierna diureza - Ostre zakażenie
- Ostre zapalenie
- Przewlekła choroba zapalna
- Nowotwór hematologiczny
– Szpiczak mnogi
– Gammopatia monoklonalna o nieokreślonym znaczeniu
– Chłoniak
– Białaczka
– Makroglobulinemia (np. makroglobulinemia Waldenstroma)
Obniżone poziomy:[4],[8],[11-16]
- Hemodylucja
– Płyny dożylne
– Zaawansowana zastoinowa niewydolność serca
– Polidypsja - Zapalenie
- Niedożywienie białkowe
- Złe wchłanianie białek
- Niewydolność wątroby
- Zaawansowana choroba wątroby
- Niewydolność nerek
- Zespół nerczycowy
- Enteropatia z utratą białka
– Pierwotne choroby błony śluzowej przewodu pokarmowego (np. wrzodziejące zapalenie jelita grubego)
– Zwiększone ciśnienie śródmiąższowe lub niedrożność limfatyczna (np. sarkoidoza)
– Nieerozyjne choroby górnego odcinka przewodu pokarmowego (np. celiakia sprue) - Pierwotny humoralny niedobór odporności (np. agammaglobulinemia)
- Przemijająca hipogammaglobulinemia niemowlęctwa (normalna i patologiczna)
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Hipochlorhydria (złe wchłanianie białek)
- Zapalenie i stres oksydacyjny
Obniżone poziomy:
- Hipochlorhydria
- Zapalenie
- Niedokrwistości
- Utrata krwi (krwotok, bolesne miesiączkowanie itp.)
Odnośniki:
- http://www.medscape.com/viewarticle/823421_4
- https://www.labtestsonline.org/understanding/analytes/tp/tab/sample/
- http://www.ncbi.nlm.nih.gov/books/NBK204/
- http://www.medscape.com/viewarticle/823421_6
- http://www.ncbi.nlm.nih.gov/books/NBK26884/
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4384109/
- http://www.uptodate.com/contents/clinical-features-laboratory-manifestations-and-diagnosis-of-multiple-myeloma
- http://www.uptodate.com/contents/transient-hypogammaglobulinemia-of-infancy
- http://www.uptodate.com/contents/recognition-of-monoclonal-proteins
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8520
- http://www.uptodate.com/contents/primary-humoral-immunodeficiencies-an-overview
- http://dx.doi.org/10.1016/S0952-8180(98)00034-8
- http://www.sciencedirect.com/science/article/pii/0031938476900123
- http://circ.ahajournals.org/content/107/2/226.abstract
- http://emedicine.medscape.com/article/182565-overview#showall
- http://dx.doi.org/10.1038/ajg.2009.561
Stosunek A/G
ZAKRESY REFERENCYJNE DLA STOSUNKU A/G:
Laboratoryjny zakres referencyjny: 1.1-2.5
Optymalny zakres referencyjny: 1.5-2.0
OPIS:
Krew zawiera dwie główne klasy krążących białek: albuminy i globuliny.[1] Matematyczny stosunek albumin do globulin w surowicy to stosunek A/G.[2] W normalnych warunkach 60% białek osocza w danej próbce to albuminy, podczas gdy pozostałe 40% to globuliny.[3] Globuliny i albuminy osocza są syntetyzowane przez wątrobę, podczas gdy immunoglobuliny są syntetyzowane przez komórki układu odpornościowego.[4]
Albumina pełni kilka funkcji w przestrzeni wewnątrznaczyniowej. Zapewnia ciśnienie osmotyczne, które pomaga zatrzymać wodę w naczyniach krwionośnych. Działa również jako białko nośnikowe dla wielu substancji, w tym wapnia, bilirubiny niesprzężonej, hormonów tarczycy i wielu leków farmaceutycznych.[4],[5] Globuliny to heterogeniczny zestaw krążących białek, który obejmuje enzymy, białka układu dopełniacza, czynniki krzepnięcia i immunoglobuliny.[1],[3],[6] Immunoglobuliny stanowią znaczną część całkowitej zawartości globulin we krwi.[1],[6] W związku z tym poziomy albuminy i immunoglobulin mają duży wpływ na stosunek A / G.
Poziom albuminy i globuliny jest regulowany na różne sposoby. Albumina jest syntetyzowana w stałym tempie przez wątrobę i ma długi okres półtrwania w porównaniu do innych białek, zwłaszcza w tkankach.[7] Poziom immunoglobulin we krwi jest stały przy braku aktywnej odpowiedzi immunologicznej. Ta odpowiedź immunologiczna może być reakcją na ostrą infekcję lub przewlekłe zapalenie autoimmunologiczne. Poziomy immunoglobulin mogą być również podwyższone w wyniku nowotworowej konwersji komórek odpornościowych (np. komórek plazmatycznych w szpiczaku mnogim).[8]
Stosunek A/G to obliczenie oparte na bezpośrednio zmierzonym poziomie albuminy i obliczonym poziomie globuliny. Białko całkowite to łączna ilość albuminy i globulin w surowicy, ale nie jest mierzona jako suma dwóch mierzonych substancji. Zamiast tego, białko całkowite to ilość wszystkich cząsteczek w próbce surowicy, które zawierają wiązania peptydowe. Innymi słowy, całkowite białko i albuminy są bezpośrednio mierzone w standardowym panelu wątrobowym, a globuliny nie.[3] Poziomy globulin są obliczane przez odjęcie poziomu albuminy od całkowitego poziomu białka. Poziom albuminy podzielony przez obliczony poziom globuliny daje stosunek A/G.[2]
Nieprawidłowo niski stosunek A/G wskazuje na niedobór albumin lub nadmiar globulin w surowicy. Poziom albuminy może być nienormalnie niski z powodu braku produkcji przez wątrobę (np. marskość wątroby) lub z powodu utraty białka (np. zespół nerczycowy).[4] Co ważne, hipoalbuminemia spowodowana utratą białka przez nerki musi być większa niż utrata globuliny, aby znacząco obniżyć stosunek A / G. Poziom globuliny może wzrosnąć w surowicy z powodu stanu zapalnego lub infekcji, lub wzrost może odzwierciedlać nowotwór hematologiczny, taki jak makroglobulinemia Waldenstroma.[4]
Standardowy panel wątrobowy obejmuje białko całkowite, albuminy, aminotransferazę alaninową (ALT), aminotransferazę octanową (AST), fosfatazę alkaliczną i bilirubinę.[12] Raport może również zawierać obliczony stosunek A / G.
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[10],[11]
- Niedobór immunoglobulin (np. agammaglobulinemia, przewlekła białaczka limfocytowa)
Obniżone poziomy:[4]
- Niedobór albuminy
– Marskość wątroby
– Zespół nerczycowy
– Analbuminemia - Nadmiar globuliny
– Ostre zakażenie/zapalenie
– Przewlekła choroba zapalna (np. gruźlica, kiła)
– Nowotwór hematologiczny
– Szpiczak mnogi
– Gammapatia monoklonalna o nieustalonym znaczeniu
– Chłoniak
– Białaczka
– Makroglobulinemia (np. makroglobulinemia Waldenstroma)
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Takie same jak wskazania konwencjonalne
Obniżone poziomy:
- Takie same jak wskazania konwencjonalne
Odnośniki:
- http://www.medscape.com/viewarticle/823421_4
- https://labtestsonline.org/understanding/analytes/tp/tab/test/
- https://labtestsonline.org/understanding/analytes/tp/tab/sample/
- http://www.medscape.com/viewarticle/823421_6
- http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8436
- http://www.ncbi.nlm.nih.gov/books/NBK204/
- http://emedicine.medscape.com/article/166724-overview#showall
- http://www.uptodate.com/contents/clinical-features-laboratory-manifestations-and-diagnosis-of-multiple-myeloma
- http://www.ncbi.nlm.nih.gov/pubmed/19473332
- http://www.uptodate.com/contents/transient-hypogammaglobulinemia-of-infancy
- http://www.uptodate.com/contents/primary-humoral-immunodeficiencies-an-overview
- https://labtestsonline.org/understanding/analytes/liver-panel/tab/test/
- http://www.nlm.nih.gov/medlineplus/ency/article/003436.htm
Glukoza
ZAKRESY REFERENCYJNE DLA GLUKOZY:
Laboratoryjny zakres referencyjny: 65–99 mg/dL
Optymalny zakres odniesienia: 75–85 mg/dL
OPIS:
Glukoza jest cukrem monosacharydowym o wzorze cząsteczkowym C6H12O6. Glukoza jest podstawowym źródłem energii większość żywych komórek w pięciu królestwach żywych organizmów. Cząsteczka jest substratem do produkcji energii poprzez oddychanie tlenowe, oddychanie beztlenowe i fermentację.[1] Glukoza może być otrzymywana z pożywienia bezpośrednio lub częściej, z rozkładu disacharydów (np. sacharozy, laktozy) i większych węglowodanów (np. skrobi) spożywanych w pożywieniu. W glukoneogenezie glukoza może być syntetyzowana z prekursorów niewęglowodanowych, takich jak mleczan i pirogronian.[1] Glukoza może być również przekształcana w glikogen, który jest dużym, rozgałęzionym polimerem cząsteczek glukozy.[2] Glikogen jest przechowywany w wątrobie i w razie potrzeby jest dostępny do szybkiego uwalniania glukozy do krwiobiegu.
Poziom glukozy we krwi jest regulowany hormonalnie przez insulinę i, w mniejszym stopniu, przez glukagon.[3] Krążąca glukoza, która zwiększa się po posiłku, jest pobierana przez komórki beta trzustki za pośrednictwem transporterów glukozy.[4] W odpowiedzi te komórki beta trzustki uwalniają insulinę do krwiobiegu. Początkowo następuje gwałtowny wzrost insuliny, który osiąga szczyt w ciągu trzech do pięciu minut, a następnie ustępuje w ciągu 10 minut.[5] Trzustka uwalnia dodatkową insulinę, jeśli poziom glukozy we krwi pozostaje podwyższony.[3] Krążąca insulina następnie wiąże się z komórkami w całym ciele, umożliwiając komórkowe wychwytywanie glukozy. Gdy glukoza dostaje się do komórek, jej stężenie spada w krwiobiegu. Jeśli stężenie glukozy we krwi spada zbyt nisko, glukagon i epinefryna stymulują komórki wątroby do rozkładania cząsteczek glikogenu na glukozę.[6] U zdrowych osób te przeciwstawne hormony utrzymują stężenie glukozy w granicach normy.
Podwyższony poziom glukozy nazywany jest hiperglikemią. U zdrowych osób występuje przemijający wzrost stężenia glukozy we krwi, ale ze względu na ścisłą regulację hormonalną poziom ten zazwyczaj nie przekracza 200 mg/dl.[7] Hiperglikemia często występuje w kontekście cukrzycy. Głównymi typami cukrzycy są typ 1, typ 2 i cukrzyca ciążowa, choć istnieje kilka mniej powszechnych odmian. Hiperglikemia może zdarzać się w ludziach które no diagnoza cukrzycy, ale nawet w te skrzynkach afektowana osoba najprawdopodobniej jakaś stopień insulinowa niewrażliwość lub insulinowy niedobór. Infekcje i różne leki, które powodują wzrost stężenia glukozy we krwi są bardziej prawdopodobne u osób z cukrzycą lub stanem przedcukrzycowym.[8],[9] Hiperglikemia może być spowodowana różnymi zaburzeniami układu hormonalnego, takimi jak zespół Cushinga lub nadczynność tarczycy.8 Choroby wpływające na funkcje zewnątrzwydzielnicze trzustki, takie jak zapalenie trzustki i mukowiscydoza, mogą również powodować hiperglikemię.[8]
Hipoglikemia wskazuje na nieprawidłowo małe stężenie glukozy we krwi. Podobnie jak w przypadku hiperglikemii, hipoglikemia jest bardziej prawdopodobna u osób z cukrzycą, zwłaszcza tych, którzy mają słabo kontrolowaną cukrzycę lub „kruchą” cukrzycę, która jest podatna na gwałtowne wahania poziomu glukozy we krwi.[10] Insulina i kilka klas doustnych leków przeciwcukrzycowych typu 2 są związane z hipoglikemią. Co więcej, różne leki na receptę mogą powodować hipoglikemię, zazwyczaj u osób z cukrzycą.[11] Hipoglikemia może wskazywać na pierwotne zaburzenia endokrynologiczne inne niż cukrzyca, takie jak niedobór glukagonu, guz chromochłonny lub choroba Addisona. Głód i niedożywienie mogą pokonać zdolność organizmu do dostarczania glukozy z zapasów glikogenu, co może powodować hipoglikemię.
Ręczne glukometry mogą zapewnić szybki i dość dokładny pomiar poziomu glukozy we krwi przy łóżku.[12] Glukoza jest mierzona jako część podstawowego panelu metabolicznego lub pełnego panelu metabolicznego.
PATOLOGICZNE/KONWENCJONALNE WSKAZANIA:
Podwyższone poziomy:[8],[9],[13]
- Cukrzyca
– Typ 1
– Typ 2
– Ciążowa
– Utajona cukrzyca autoimmunologiczna u dorosłych
– Dojrzałość początku cukrzycy młodych
– Noworodki - Genetyczne wady działania insuliny (np. insulinooporność typu A)
- Choroby zewnątrzwydzielniczej trzustki (np. zapalenie trzustki, mukowiscydoza)
- Endokrynopatie (np. akromegalia, zespół Cushinga, nadczynność tarczycy)
- Zakażenia (np. cytomegalowirus, różyczka)
- Leki
– Antybiotyki (np. chinolony)
– Atypowe leki przeciwpsychotyczne (np. klozapina, olanzapina)
– Beta-blokery (np. metoprolol, propranolol)
– Kortykosteroidy
– Inhibitory kalcyneuryny (np. cyklosporyna, takrolimus)
– Inhibitory proteazy
– Tiazydowe leki moczopędne
Obniżone poziomy:[11],[14],[15]
- Cukrzyca
- Choroba wątroby
- Zaburzenia endokrynologiczne (np. niedobór glukagonu, choroba Addisona)
- Niedożywienie
- Nadużywanie alkoholu
- Nadużywanie substancji
- Jamajska choroba wymiotów
- Chirurgia żołądka
- Nadmierna aktywność mięśni
- Biegunka (dzieciństwo)
- Leki
– Antybiotyki (np. chinolony, chloramfenikol, pentamidyna)
– Inhibitory ACE (np. enalapryl, lizynopryl)
– Beta-blokery (np. metoprolol, propranolol)
– Salicylany (np. aspiryna)
– Leczenie cukrzycy
– Insulina
– Sulfonylomocznik
– Inhibitory DPP-4
– Inhibitory SGLT2
– Inhibitory alfa-glukozydazy
– Chlorochina
– Klofibrat
– Dyzopiramid
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Wczesne stadia upośledzonej tolerancji glukozy i insulinooporności
- Aktywna reakcja na stres
Obniżone poziomy:
- Reaktywna hipoglikemia
- Hipoglikemia (może nadal występować, gdy stężenie glukozy jest większe niż 65)
- Zaburzenia czynności wątroby
Odnośniki:
- http://www.ncbi.nlm.nih.gov/books/NBK21150/
- http://www.ncbi.nlm.nih.gov/books/NBK21190/
- http://www.uptodate.com/contents/insulin-secretion-and-pancreatic-beta-cell-function
- http://diabetes.diabetesjournals.org/content/41/1/76.abstract
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC372111/
- http://www.ncbi.nlm.nih.gov/books/NBK22429/
- http://www.uptodate.com/contents/screening-for-type-2-diabetes-mellitus
- http://www.uptodate.com/contents/image?imageKey=ENDO/59403&topicKey=ENDO%2F1793&source=outline_link&search=Diabetes+mellitus&selectedTitle=6%7E150&utdPopup=true
- http://spectrum.diabetesjournals.org/content/24/4/234.short
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1669942/
- http://spectrum.diabetesjournals.org/content/24/3/171.short
- http://www.ncbi.nlm.nih.gov/pubmed/20151773
- http://www.uptodate.com/contents/classification-of-diabetes-mellitus-and-genetic-diabetic-syndromes
- http://care.diabetesjournals.org/content/28/12/2948.short
- http://emedicine.medscape.com/article/122122-differential
BUN
ZAKRESY REFERENCYJNE DLA BUN:
Laboratoryjny zakres referencyjny: 6-24 mg/dL
Optymalny zakres referencyjny: 13-18 mg/dL
OPIS:
Mocznik jest rozpuszczalnym w wodzie końcowym produktem metabolizmu białek, który może być wydalany z moczem.[1] BUN, czyli azot mocznikowy we krwi, to ilość azotu mocznikowego we krwi. Mocznik nie zapewnia żadnych znanych korzyści fizjologicznych u ludzi poza tym, że jest produktem odpadowym. Niemniej jednak, BUN jest klinicznie użytecznym badaniem laboratoryjnym, które jest mierzone zasadniczo u każdej osoby, która otrzymuje zlecenie rutynowego badania krwi.[2],[3]
Mocznik powstaje w cyklu mocznikowym, znanym również jako cykl ornitynowy.[4] Wątroba jest głównym źródłem produkcji mocznika, ale część produkcji mocznika odbywa się również w nerkach i jelitach. Azot znajdujący się w moczniku może pochodzić ze spożytych białek lub katabolizmu mięśni.[1] Każda cząsteczka mocznika zawiera dwa atomy azotu, jeden z amoniaku i jeden z asparaginianu, połączone przez enzym arginazę.[5] Funkcja cyklu mocznikowego zależy od aktywacji syntazy fosforanu karbamoilu przez N-acetyloglutaminian.[6] Po zsyntetyzowaniu mocznik biernie dyfunduje przez błony komórkowe i znajduje się w krwiobiegu.[7] Mocznik jest wydalany przez nerki lub, w mniejszym stopniu, z potem. Poziom BUN wzrasta o około 50 procent od okresu niemowlęcego do dorosłości, a poziom BUN jest zwykle nieco wyższy u mężczyzn niż u kobiet.[8],[9]
BUN zmienia się odwrotnie do szybkości filtracji kłębuszkowej. Oznacza to, że wzrost BUN koreluje ze spadkiem czynności nerek.[10] Jednak BUN nie jest dokładnym miernikiem szybkości filtracji kłębuszkowej z dwóch powodów.[10] Po pierwsze, szybkość produkcji mocznika nie jest stała i może znacznie wzrosnąć u pacjentów stosujących diety wysokobiałkowe lub w kontekście zwiększonego katabolizmu tkanek. I odwrotnie, dieta niskobiałkowa lub choroby wątroby mogą zmniejszać BUN niezależnie od czynności nerek. Po drugie, około połowa mocznika filtrowanego przez kłębuszki nerkowe jest biernie wchłaniana w kanalikach proksymalnych. W związku z tym BUN będzie się zmieniać wraz ze zmianą szybkości wchłaniania zwrotnego sodu i wody. Z tych powodów poziom kreatyniny we krwi jest znacznie dokładniejszym miernikiem szybkości filtracji kłębuszkowej i ogólnej czynności nerek.
Jako narzędzie kliniczne, BUN jest najbardziej przydatny, gdy jest interpretowany w kontekście poziomu kreatyniny we krwi. W normalnych warunkach stosunek BUN do kreatyniny wynosi od 10:1 do 20:1. Jeśli stosunek BUN do kreatyniny przekracza 20:1, wskazuje to na uszkodzenie przednerkowe i, najczęściej, zmniejszoną perfuzję nerek.[11],[12]
BUN jest również przydatny do szacowania szybkości filtracji kłębuszkowej w zaawansowanej niewydolności nerek.[13] W zaawansowanej chorobie nerek klirens kreatyniny przecenia czynność nerek, podczas gdy klirens mocznika ją zaniża. Dlatego wskaźnik filtracji kłębuszkowej można dokładniej oszacować w zaawansowanej niewydolności nerek, uśredniając wskaźniki klirensu obu cząsteczek.[14]
Podwyższony poziom mocznika we krwi może być określany jako mocznica lub azotemia. Mocznica ogólnie odzwierciedla cięższy stan kliniczny, w którym różne elektrolity we krwi są nieprawidłowe poza BUN. Mocznica jest często używana zamiennie ze schyłkową niewydolnością nerek lub zaawansowaną niewydolnością nerek.[15] Z drugiej strony azotemia odzwierciedla szeroki zestaw etiologii łagodnych do umiarkowanych wzrostów BUN. Azotemia jest czasami używana zamiennie z terminem choroba przednerkowa lub po prostu azotemia przednerkowa.[16] Najczęstsze przyczyny podwyższonego BUN obejmują zmniejszoną perfuzję nerek, ostrą lub przewlekłą chorobę nerek lub leki. W rzeczywistości duża liczba leków z różnych klas może zwiększać stężenie BUN.[8],[10]
Nieprawidłowo niski poziom BUN w izolacji rzadko jest powodem do niepokoju. Chociaż obniżony poziom BUN może wystąpić w kontekście ciężkiej choroby wątroby, stan ten jest zwykle oczywisty na podstawie innych dowodów klinicznych i laboratoryjnych. BUN może być również niski z powodu nadmiernego nawodnienia (np. pierwotna polidypsja, jatrogenna). Niski poziom BUN zwykle odzwierciedla dietę niskobiałkową lub jest efektem ubocznym leków, takich jak chloramfenikol i streptomycyna.
BUN jest zawsze mierzony wraz z kreatyniną, a te dwie wartości są głównymi sposobami oszacowania szybkości filtracji kłębuszkowej i czynności nerek.[10] BUN jest mierzony jako część podstawowego panelu metabolicznego lub pełnego panelu metabolicznego. W zależności od sytuacji klinicznej, BUN może być również mierzony wraz z poziomem amoniaku we krwi i analizą moczu.
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[8],[17-19]
- Hipowolemia/odwodnienie
- Dieta wysokobiałkowa
- Całkowite żywienie pozajelitowe
- Krwotok z przewodu pokarmowego
- Kwasica ketonowa
- Choroby nerek
– Kłębuszkowe zapalenie nerek (ostre lub przewlekłe)
– Odmiedniczkowe zapalenie nerek
– Ostra martwica kanalików nerkowych
– Śródmiąższowe zapalenie nerek
– Schyłkowa niewydolność nerek - Niedrożność moczowodu
- Wstrząs
- Zastoinowa niewydolność serca
- Oparzenie termiczne
- Niedawny zawał serca
- Leki
– Leki moczopędne (np. furosemid, hydrochlorotiazyd)
– Antybiotyki (np. tetracykliny)
– Leki przeciw dnie moczanowej (np. allopurynol, probenecyd)
– Chemioterapeutyki (np. cisplatyna)
Obniżone poziomy:[8]
- Dieta niskobiałkowa
- Niedożywienie
- Nadmierne podawanie płynów
- Polidypsja
- Leki
– Streptomycyna
– Chloramfenikol
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Łagodnym odwodnieniu
- Upośledzona czynność nerek
- Nieodpowiednie spożycie sodu
- Stres
- Hipochlorhydria
- Niedrożność dróg moczowych
Obniżone poziomy:
- Upośledzona czynność wątroby
- Słaby stan składników odżywczych/niedostateczne wchłanianie
- Celiakia
- Hipochlorhydria
- Stosowanie sterydów anabolicznych
- Upośledzona czynność nerek
Odnośniki:
- http://www.uptodate.com/contents/urea-cycle-disorders-clinical-features-and-diagnosis
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1025851/
- http://www.clinchem.org/content/12/3/137.abstract
- http://physrev.physiology.org/physrev/70/3/701.full.pdf
- http://www.uptodate.com/contents/image?imageKey=PEDS%2F60652&topicKey=ALLRG%2F2929&rank=2%7E150&source=see_link&search=BUN
- http://www.ncbi.nlm.nih.gov/pubmed?term=20227314
- http://www.ncbi.nlm.nih.gov/books/NBK21626/
- http://emedicine.medscape.com/article/2073979-overview#a2
- http://www.ncbi.nlm.nih.gov/pubmed?term=16760447
- http://www.uptodate.com/contents/assessment-of-kidney-function
- http://www.ncbi.nlm.nih.gov/pubmed/?term=10779250
- http://ckj.oxfordjournals.org/content/5/2/187.abstract
- http://ndt.oxfordjournals.org/content/20/suppl_9/ix3.short
- http://www.ncbi.nlm.nih.gov/pubmed?term=6071183
- http://www.uptodate.com/contents/overview-of-the-management-of-chronic-kidney-disease-in-adults
- http://www.ncbi.nlm.nih.gov/pubmed/12549657
- https://nlm.nih.gov/medlineplus/ency/article/003474.htm
- http://www.uptodate.com/contents/etiology-and-diagnosis-of-prerenal-disease-and-acute-tubular-necrosis-in-acute-kidney-injury-acute-renal-failure
- http://www.ncbi.nlm.nih.gov/pubmed/16932399
Stosunek BUN do kreatyniny
ZAKRESY REFERENCYJNE DLA STOSUNKU BUN/KREATYNINA:
Laboratoryjny zakres referencyjny:[1]
| BUN:Kreatynina | Mocznik:Kreatynina | Lokalizacja | Mechanizm |
|---|---|---|---|
| >20:1 | >100:1 | Przednerkowy (przed nerką) | Reabsorpcja BUN jest zwiększona. BUN jest nieproporcjonalnie podwyższony w stosunku do kreatyniny w surowicy. Podejrzewa się odwodnienie lub hipoperfuzję. |
| 10-20:1 | 40-100:1 | Normalny lub nadnerczowy (za nerką) | Normalny zakres. Może to być również choroba nadnerczy. Reabsorpcja BUN mieści się w granicach normy. |
| <10:1 | <40:1 | Wewnątrznerkowy(wewnątrz nerki) | Uszkodzenie nerek powoduje zmniejszone wchłanianie zwrotne BUN, obniżając tym samym stosunek BUN:Cr. |
Optymalny zakres referencyjny: taki sam jak zakres laboratoryjny
OPIS:
Mocznik jest rozpuszczalnym w wodzie produktem ubocznym metabolizmu białek w cyklu mocznikowym (cyklu ornitynowym).[2] Azot mocznikowy we krwi (BUN) jest miarą azotu zawartego w cząsteczkach mocznika. Kreatynina jest rozpuszczalnym w wodzie produktem odpadowym katabolizmu białek, w szczególności białek mięśniowych. Ani BUN, ani kreatynina nie mają znanego działania fizjologicznego w organizmie, jednak te biomarkery są rutynowo mierzone w warunkach klinicznych.[3],[4] Stosunek BUN do kreatyniny może dostarczyć przydatnych informacji klinicznych na temat objętości krwi i perfuzji nerek.[2]
Mięśnie produkują kreatyninę w stałym tempie, proporcjonalnym do całkowitej masy mięśniowej.[5],[6] Praktycznie cała kreatynina we krwi jest całkowicie filtrowana przez nerki i nie jest ponownie wchłaniana.[5] Kreatynina zmienia się odwrotnie do współczynnika filtracji kłębuszkowej (GFR) i jest użytecznym biomarkerem do szacowania GFR. Z drugiej strony produkcja BUN nie jest stała.[7],[8] Po wytworzeniu mocznika jest on filtrowany przez nerki.[9] Jednak około połowa przefiltrowanego mocznika jest biernie wchłaniana ponownie w kanaliku proksymalnym nerki.[2] Podczas gdy BUN i kreatynina zmieniają się odwrotnie z GFR, poziomy BUN mogą wzrosnąć bez współistniejącej choroby nerek.[10] Z tych powodów kreatynina jest zwykle lepszym miernikiem GFR niż BUN. Wyjątkiem jest zaawansowana choroba nerek, w której GFR jest dokładniej szacowany poprzez uśrednienie klirensu zarówno BUN, jak i GFR.[11],[12]
Stosunek BUN do kreatyniny jest używany głównie do wykrywania uszkodzenia przednerkowego, które występuje w wyniku zmniejszonego przepływu krwi do nerek.[13] Gdy objętość wewnątrznaczyniowa zmniejsza się, kanalik proksymalny nerki zatrzymuje sód i wodę, aby to zrekompensować.[13] Towarzyszy temu wzrost reabsorpcji mocznika przez nerki i podwyższenie poziomu kreatyniny we krwi.[2] Z drugiej strony poziomy kreatyniny pozostają względnie stabilne w tym stanie. W związku z tym stosunek BUN do kreatyniny wynoszący 20 lub więcej najczęściej wskazuje na chorobę przednerkową. Mogą jednak istnieć inne przyczyny nieprawidłowo wysokiego stosunku BUN/kreatyniny. Krwawienie z przewodu pokarmowego może powodować nieproporcjonalnie duży wzrost BUN w stosunku do kreatyniny.[11],[14] Leczenie kortykosteroidami może również nieproporcjonalnie podnosić poziom BUN.[14] W rzeczywistości duża liczba leków może zwiększać BUN bez znaczącego wpływu na kreatyninę.[2],[5] Odwrotnie, zanik mięśni może zmniejszyć produkcję kreatyniny do tego stopnia, że stosunek BUN/kreatynina jest nienormalnie wysoki pomimo prawidłowego poziomu BUN.[11]
Normalne i nienormalnie niskie wyniki stosunku BUN/kreatyniny muszą być rozpatrywane w kontekście klinicznym i często nie są przydatne klinicznie.[13] Na przykład, choroba przednerkowa może występować u pacjenta z prawidłowym stosunkiem BUN/kreatyniny, jeśli produkcja mocznika jest z jakiegoś powodu nienormalnie niska. Podobnie, nieprawidłowo niski stosunek BUN do kreatyniny jest zwykle spowodowany obniżonym BUN w kontekście prawidłowego stężenia kreatyniny.[15] Może to być spowodowane niewydolnością wątroby, zmniejszonym spożyciem białka lub ciężką wielomoczem/polidypsją.[15] Masywny wzrost stężenia kreatyniny może również skutkować nieprawidłowo niskim stosunkiem BUN do kreatyniny, np. w przypadku zapalenia mięśni, rabdomiolizy lub innych poważnych urazów mięśni.[15] Cefalosporyny, witamina C i flucytozyna mogą fałszywie zwiększać stężenie kreatyniny w surowicy bez wpływu na mierzone stężenie BUN, zmniejszając stosunek BUN do kreatyniny.[15]
Kreatynina i BUN są rutynowo mierzone jako część podstawowego panelu metabolicznego lub pełnego panelu metabolicznego.[5]
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[13],[15]
- Uraz przednerkowy
– Hipowolemia
– Niedociśnienie
– Zastoinowa niewydolność serca
– Zespół nerczycowy - Krwotok z przewodu pokarmowego
- Zanik mięśni
- Leki
– Leki moczopędne (np. furosemid, hydrochlorotiazyd)
– Antybiotyki (np. tetracykliny)
– Leki przeciw dnie moczanowej (np. allopurynol, probenecyd)
– Chemioterapeutyki (np. cisplatyna)
Obniżone poziomy:[15]
- Niskie spożycie białka
- Niewydolność wątroby
- Ciężka poliuria/polidypsja
– Moczówka prosta
– Cukrzyca (niekontrolowana)
– Choroba Cushinga - Uszkodzenie mięśni
– Zapalenie mięśni
– Rabdomioliza
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Takie same jak wskazania konwencjonalne
Obniżone poziomy:
- Takie same jak wskazania konwencjonalne
Odnośniki:
- https://en.wikipedia.org/wiki/BUN-to-creatinine_ratio#Interpretation
- http://emedicine.medscape.com/article/2073979-overview#a2
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1025851/
- http://www.clinchem.org/content/12/3/137.abstract
- http://www.uptodate.com/contents/assessment-of-kidney-function
- http://www.ncbi.nlm.nih.gov/pubmed?term=16760447
- http://www.ncbi.nlm.nih.gov/pubmed?term=20227314
- http://physrev.physiology.org/physrev/70/3/701.full.pdf
- http://www.ncbi.nlm.nih.gov/books/NBK21626/
- http://www.ncbi.nlm.nih.gov/pubmed/2200925
- http://www.ncbi.nlm.nih.gov/pubmed?term=6071183
- http://ndt.oxfordjournals.org/content/20/suppl_9/ix3.short
- http://www.uptodate.com/contents/etiology-and-diagnosis-of-prerenal-disease-and-acute-tubular-necrosis-in-acute-kidney-injury-acute-renal-failure
- http://www.uptodate.com/contents/etiology-clinical-manifestations-and-diagnosis-of-volume-depletion-in-adults
- http://www.idexx.eu/globalassets/documents/parameters/8073-us-bcratio-interpretive-summary.pdf
Magnez
ZAKRESY REFERENCYJNE DLA MAGNEZU W SUROWICY:
Laboratoryjny zakres referencyjny: 1,6–2,6 mg/dL
Optymalny zakres odniesienia: 2,0–2,6 mg/dL
OPIS:
Magnez (Mg) jest kofaktorem dla ponad 300 enzymów, składnikiem kości i zębów, i jest potrzebny każdej komórce. Magnez jest niezbędny dla wszystkich enzymów, które wykorzystują i syntetyzują ATP oraz dla enzymów zaangażowanych w syntezę RNA, DNA, białek i glutationu. Każda komórka wykorzystuje magnez do aktywnego transportu jonów wapnia i potasu przez błony komórkowe, co jest ważne dla funkcjonowania mięśni i nerwów oraz prawidłowego rytmu serca. Pomaga regulować ciśnienie krwi, poziom glukozy i innych składników odżywczych, w tym wapnia, witaminy D, potasu, cynku i miedzi.[1-4]
Ocena stanu magnezu jest trudna, ponieważ mniej niż 1% całkowitego magnezu znajduje się w surowicy krwi, reszta znajduje się w kościach i komórkach.[3],[5] Stężenie magnezu w surowicy krwi jest najczęściej stosowanym testem magnezu, ale test ten jest wadliwy, ponieważ poziom magnezu w surowicy krwi jest ściśle regulowany i nie koreluje dobrze z ogólnym stanem magnezu.[6] Stan magnezu jest również oceniany za pomocą testów obciążenia magnezem (tolerancji), całkowitego stężenia magnezu w erytrocytach (RBC), ślinie i moczu lub całkowitego stężenia zjonizowanego magnezu krwi, osocza i surowicy. Jednakże nie istnieje jedna wystarczająca metoda badania statusu magnezu; potrzebny jest lepszy funkcjonalny biomarker.[7],[8]
Bilans magnezu uzyskuje się przede wszystkim poprzez wchłanianie w jelicie cienkim oraz wydalanie i resorpcję nerkową. W przeciwieństwie do innych jonów, hormony nie regulują zasadniczo wydalania magnezu z moczem, a zawartość magnezu w kościach nie jest łatwo mobilizowana do krążącego magnezu. Zamiast tego niskie stężenie magnezu w osoczu powoduje, że nerki obniżają wydalanie magnezu i zapobiegają jego dalszemu wyczerpywaniu.[9]
Wysoki poziom magnezu występuje niezbyt często, ale może być spowodowany niewystarczającą czynnością nerek lub bardzo wysokim spożyciem magnezu. Nieznacznie podwyższony poziom magnezu może być spowodowany pierwotną nadczynnością przytarczyc, cukrzycową kwasicą ketonową, zespołem lizy guza, lekami takimi jak lit, zespołem mleczno-alkalicznym, niewydolnością nadnerczy i rodzinną hiperkalcemią hipokalciuryczną.[10],[11]
Niski poziom magnezu jest powszechny. Główną przyczyną niedoboru magnezu jest niskie spożycie w diecie; zdecydowana większość Amerykanów spożywa znacznie poniżej szacowanego średniego zapotrzebowania (EAR).[12] W przypadku niskiego poziomu magnezu należy również wziąć pod uwagę nadczynność tarczycy, obfite miesiączki, nadmierne pocenie się, przewlekły stres, zespół głodnych kości, utratę magnezu żołądkowo-jelitowego (biegunka, złe wchłanianie, zapalenie trzustki), utratę magnezu w nerkach (cukrzyca typu 2, pierwotny aldosteronizm, hiperkalcemię, dysfunkcję kanalików nerkowych, Ptospiroza), niektóre leki (inhibitory pompy protonowej, leki moczopędne), różne zaburzenia genetyczne, zabiegi chirurgiczne i inne czynniki dietetyczne (dieta ketogeniczna, kawa, alkohol).[9],[10],[13-15]
W przypadku leczenia niskiego poziomu magnezu należy pamiętać, że suplementy magnezu podają ilość pierwiastkowego magnezu na porcję w panelu Fakty o suplementach, a nie całkowitą masę związków zawierających magnez.[1]
PATOLOGICZNE/KONWENCJONALNE WSKAZANIA:
Podwyższone poziomy:[10],[11]
- Niewydolność nerek
- Nadmierne spożycie magnezu
– Pozajelitowe leczenie magnezem w ciężkim stanie przedrzucawkowym lub rzucawkowym u kobiet w ciąży
– Bardzo duże dawki soli Epsom (siarczanu magnezu)
– Katharsis z lekami zawierającymi magnez (zwłaszcza u dzieci, osób starszych i osób z chorobami przewodu pokarmowego)
– Lewatywy magnezowe
– Zatrucie wodą z Morza Martwego - Łagodna hipermagnezemia
– Cukrzycowa kwasica ketonowa
– Zespół rozpadu guza
– Spożycie litu
– Zespół mleczno-alkaliczny
– Niewydolność nadnerczy
– Rodzinna hiperkalcemia hipokalciuryczna
– Niektóre przypadki pierwotnej nadczynności przytarczyc (chociaż ten stan może również skutkować niskim poziomem magnezu)
Obniżone poziomy:[9],[10],[12-15]
- Nieodpowiednie spożycie pokarmu
- Czynniki dietetyczne (np. dieta ketogeniczna, kawa, napoje gazowane, alkohol, nadmierne spożycie sodu)
- Nadczynność tarczycy
- Ciężkie miesiączki
- Nadmierne pocenie się
- Długotrwały stres
- Zespół głodnych kości (po parathyroidektomii)
- Stany utraty magnezu z przewodu pokarmowego
– Biegunka
– Złe wchłanianie
– Steatorroza
– Chirurgia bypassu jelita cienkiego
– Ostre zapalenie trzustki - Stany utraty magnezu przez nerki
– Przewlekłe zwiększenie objętości płynu pozakomórkowego
– Pierwotny aldosteronizm
– Alkoholizm
– Cukrzyca typu 2, zwłaszcza niekontrolowana
– Hiperkalcemia
– Pierwotna nadczynność przytarczyc
– Nerkowe marnowanie magnezu z powodu dysfunkcji kanalików nerkowych
– Wyzdrowienie z ostrej martwicy kanalików
– Po przeszczepieniu nerki
– Podczas diurezy poobstrukcyjnej
– Leptospiroza - Stany wewnątrznaczyniowej chelatacji magnezu
– Po zabiegu
– Podczas transplantacji wątroby - Zaburzenia genetyczne
– Mutacja w genie TRPM6, która powoduje zarówno pierwotną jelitową hipomagnezemię, jak i nerkową utratę magnezu
– Rodzinne pierwotne nerkowe wyniszczenie magnezu, rzadka diagnoza wykluczenia
– Zespół Gitelmana jest najczęstszym, spowodowanym mutacjami w genie SLC12A3, który koduje wrażliwy na tiazydy kotransporter chlorku sodu (NCC)
– Rodzinna hipomagnezemia z hiperkalciurią i nefrokalcynozą (FHHNC), najczęściej spowodowana mutacjami w genie CLDN16 (znanym również jako HOMG3 lub PCLN1) i sporadycznie spowodowana mutacjami w genie CLDN19
– Różne rzadziej występujące zaburzenia genetyczne
– Leki
– Inhibitory pompy protonowej (np. omeprazol), zwłaszcza gdy są stosowane dłużej niż jeden rok lub gdy są stosowane jednocześnie z lekami moczopędnymi
– Leki pętlowe i tiazydowe
– Antybiotyki aminoglikozydowe
– Amfoterycyna B
– Cisplatyna
– Pentamidyna
– Cyklosporyna
– Przeciwciała skierowane przeciwko receptorom naskórkowego czynnika wzrostu (EGF) (cetuksymab, panitumumab, matuzumab)
– Leczenie foskarnetem zapalenia naczyniówki i siatkówki wywołanego wirusem cytomegalii
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Niedoczynność tarczycy
- Zaburzenia czynności nerek
- Stosowanie leków zobojętniających kwas żołądkowy z magnezem
- Nadmierna suplementacja magnezem
- choroba Addison’sa / nadnercza niewydolność
Obniżone poziomy:
- Niedobór magnezu
- Złe wchłanianie
- Utrata płynu
- Wiele innych stanów chorobowych
Odnośniki:
- https://ods.od.nih.gov/factsheets/Magnesium-HealthProfessional/#en7
- https://www.nap.edu/read/5776/chapter/1
- Rude RK. Magnesium. In: Coates PM, Betz JM, Blackman MR, Cragg GM, Levine M, Moss J, White JD, eds. Encyclopedia of Dietary Supplements. 2nd ed. New York, NY: Informa Healthcare; 2010:527-37.
- Rude RK. Magnesium. In: Ross AC, Caballero B, Cousins RJ, Tucker KL, Ziegler TR, eds. Modern Nutrition in Health and Disease. 11th ed. Baltimore, Mass: Lippincott Williams & Wilkins; 2012:159-75.
- Volpe SL. Magnesium. In: Erdman JW, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames, Iowa; John Wiley & Sons, 2012:459-74.
- Gibson, RS. Principles of Nutritional Assessment, 2nd ed. New York, NY: Oxford University Press, 2005.
- http://www.ncbi.nlm.nih.gov/pubmed/22064327?dopt=Abstract
- http://www.tandfonline.com/doi/abs/10.1080/07315724.2004.10719418#.Ve8-sM44Is
- http://www.uptodate.com/contents/regulation-of-magnesium-balance
- http://www.uptodate.com/contents/causes-of-hypomagnesemia
- http://www.uptodate.com/contents/causes-and-treatment-of-hypermagnesemia
- https://www.ars.usda.gov/ARSUserFiles/80400530/pdf/0506/usual_nutrient_intake_vitD_ca_phos_mg_2005-06.pdf
- http://acb.sagepub.com/content/51/2/179
- http://ckj.oxfordjournals.org/content/5/Suppl_1/i25
- http://umm.edu/health/medical/altmed/supplement/magnesium
Wapń w surowicy
ZAKRESY REFERENCYJNE DLA WAPNIA W SUROWICY:
Laboratoryjny zakres referencyjny: 8,7-10,2 mg/dL
Optymalny zakres referencyjny: 9,2-10,1 mg/dL
OPIS:
Wapń jest jonem dwuwartościowym, który odgrywa ważną rolę w sygnalizacji komórkowej, krzepnięciu krwi, skurczu mięśni i funkcjonowaniu nerwów.[1],[2] Praktycznie cały wapń w organizmie znajduje się w kościach i zębach.[1] Stosunkowo niewielką ilość wapnia można znaleźć pozakomórkowo (tj. w surowicy) i wewnątrz komórek. Ze względu na potencjalnie toksyczne działanie wolnego wapnia wewnątrzkomórkowego, wapń w komórkach jest przechowywany w organellach związanych z błoną i uwalniany tylko w określonych okolicznościach, takich jak skurcz mięśni lub uwalnianie neuroprzekaźników.[3]
Całkowity poziom wapnia w organizmie jest regulowany przez złożoną interakcję czynników, które zachodzą w jelitach, nerkach i kościach.[4] Homeostaza wapnia jest regulowana przez hormon przytarczyc (PTH), witaminę D, czynnik wzrostu fibroblastów 23 (FGF-23), kalcytoninę i estrogen.[4],[5] Poziomy wapnia są regulowane głównie przez przytarczyce, które opierają się na receptorach wyczuwających wapń w celu wykrycia poziomu wapnia we krwi i reagują odpowiednimi zmianami w wydzielaniu PTH.[5] PTH w surowicy i wapń w surowicy są zwykle odwrotnie skorelowane.[6]
PTH działa szybko, zwiększając poziom wapnia we krwi poprzez wiele mechanizmów, w tym zwiększoną resorpcję kości, zwiększoną reabsorpcję wapnia przez nerki, zwiększony poziom witaminy D we krwi, a z kolei zwiększone wchłanianie wapnia w jelicie cienkim. Wraz ze wzrostem stężenia wapnia w surowicy zmniejsza się stężenie PTH.[5] FGF-23 generalnie działa w opozycji do PTH, obniżając stężenie fosforanów i witaminy D oraz hamując wydzielanie samego PTH.[4],[5]
Wapń w surowicy występuje w jednej z trzech postaci: 40% jest związane z albuminami, 15% jest związane z anionami organicznymi i nieorganicznymi (np. siarczanami, fosforanami, mleczanami, cytrynianami), a pozostałe 45% to wapń zjonizowany lub “wolny”.[7] Całkowite stężenie wapnia w surowicy jest na ogół dobrym odzwierciedleniem całkowitego wapnia, z wyjątkiem hipoalbuminemii, zaburzeń kwasowo-zasadowych i przewlekłej choroby nerek.[4],[7] W przypadku hipoalbuminemii rzeczywisty poziom wapnia można oszacować, korygując go o albuminy za pomocą następującego równania:[7]
Skorygowany [Ca] = zmierzony całkowity [Ca] + (0,8 (4,0 -[Alb]))
Hiperkalcemia może być spowodowana nieprawidłowościami w działaniu lub regulacji PTH. Na przykład hiperkalcemia i podwyższony poziom PTH mogą współwystępować w pierwotnej nadczynności przytarczyc z powodu upośledzonego ujemnego sprzężenia zwrotnego PTH w przytarczycach. Hiperkalcemia spowodowana nowotworem złośliwym może, ale nie musi być związana z PTH.[8] Samo spożycie wapnia rzadko jest przyczyną podwyższonego stężenia wapnia w surowicy; jednak nadmierna suplementacja witaminą D może prowadzić do hiperkalcemii.[9] Niewydolność nerek prowadzi do stanu zwanego trzeciorzędową nadczynnością przytarczyc, a w konsekwencji do hiperkalcemii.[9]
Podobnie jak w przypadku podwyższonego stężenia wapnia w surowicy, hipokalcemia może, ale nie musi być związana z nieprawidłowościami w PTH. Niedobór magnezu jest częstą przyczyną niewielkiej hipokalcemii; może wystąpić w kontekście wysokich, niskich lub prawidłowych poziomów PTH, ponieważ może zmniejszać wydzielanie PTH lub zakłócać funkcję PTH.[10]
PTH w surowicy jest najbardziej przydatnym testem do rozróżniania etiologii hipokalcemii.[11] Magnez w surowicy, kreatynina, fosforan, metabolity witaminy D (głównie 25-hydroksywitamina D) i fosfataza alkaliczna mogą również dostarczyć pomocnych informacji.[11] Poziom albuminy może być wymagany do identyfikacji i korekty hipoalbuminemii.
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[12-14]
- Brak równowagi składników odżywczych
– Nadmiar witaminy D
– Nadmiar witaminy A
– Nadmierne spożycie wapnia (rzadko) - Pierwotna nadczynność przytarczyc
- Nadczynność tarczycy
- Niewydolność nadnerczy
- Żywienie pozajelitowe
- Zespół zasad mlecznych
- Rodzinna hipokalciuryczna hiperkalcemia
- Rodzinna izolowana nadczynność przytarczyc
- Akromegalia
- Niewydolność nerek (trzeciorzędowa nadczynność przytarczyc)
- Rozsiane nowotwory gruczołów dokrewnych
- Guz chromochłonny
- Nowotwór złośliwy
- Przewlekła choroba ziarniniakowa
- Bezruch
- Leki
– Diuretyki tiazydowe
– Lit
– Teofilina
Obniżone poziomy:[10],[11]
- Stany niskiego stężenia PTH (niedoczynność przytarczyc)
– Hipomagnezemia ze zmniejszonym wydzielaniem PTH
– Pooperacyjne (np. tyreoidektomia, paratyroidektomia, radykalne wycięcie szyi)
– Zespół głodnych kości (po paratyroidektomii)
– Autoimmunologiczne (np. autoimmunologiczny zespół wielogruczołowy)
– Infiltracja przytarczyc (ziarniniak, przeciążenie żelazem, przerzuty)
– Izolowana niedoczynność przytarczyc spowodowana aktywacją przeciwciał przeciwko receptorowi wyczuwającemu wapń
– Wywołane promieniowaniem zniszczenie przytarczyc
– Różne zaburzenia genetyczne
– Zakażenie wirusem HIV - Stany wysokiego PTH (wtórna nadczynność przytarczyc w odpowiedzi na hipokalcemię)
– Niedobór lub oporność na witaminę D
– Oporność na hormon przytarczyc
– Hipomagnezemia z opornością na hormon przytarczyc
– Choroba nerek
– Utrata wapnia z krążenia
– Hiperfosfatemia
– Liza guza
– Ostre zapalenie trzustki
– Przerzuty osteoblastyczne
– Ostra zasadowica oddechowa
– Sepsa lub ostra ciężka choroba
– Leki
– Zatrucie fluorem
– Chelatory wapnia (EDTA, cytrynian, fosforan)
– Inhibitory resorpcji kości (np. bisfosfoniany, kalcytonina)
– Cynakalcet
– Foscarnet
– Fenytoina
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:[13]
- Odwodnienie (powodujące łagodną lub przejściową hiperkalcemię)
- Nadmierna suplementacja witaminy D
- Nadmiar wapnia
- Bezruch
- Leki (np. lit)
Obniżone poziomy:[15]
- Czynniki dietetyczne: kofeina, fosforany (znajdujące się w napojach gazowanych), wysokie spożycie fitynianów
- Niedobór witaminy D
- Niedobór magnezu
- Niski poziom kwasu żołądkowego
- Przewlekła niewydolność nerek
- Alkoholizm
- Leki (bisfosfoniany, leki moczopędne, antybiotyki, estrogenowe terapie zastępcze, insulina, nadmierne stosowanie środków przeczyszczających)
Odnośniki:
- http://www.ncbi.nlm.nih.gov/books/NBK279023/
- https://www.nlm.nih.gov/medlineplus/ency/article/002412.htm
- http://www.ncbi.nlm.nih.gov/pubmed/12805727
- http://www.uptodate.com/contents/regulation-of-calcium-and-phosphate-balance
- http://dx.doi.org/10.1038/nrrheum.2012.157
- http://www.uptodate.com/contents/image?imageKey=ENDO/50252&topicKey=ENDO%2F836&source=outline_link&utdPopup=true
- http://www.uptodate.com/contents/relation-between-total-and-ionized-serum-calcium-concentrations
- http://www.uptodate.com/contents/hypercalcemia-of-malignancy
- http://www.uptodate.com/contents/etiology-of-hypercalcemia
- http://www.uptodate.com/contents/image?imageKey=ENDO%2F62899&topicKey=ENDO%2F837&rank=3~150&source=see_link&search=hypocalcemia&utdPopup=true
- http://www.uptodate.com/contents/diagnostic-approach-to-hypocalcemia
- http://emedicine.medscape.com/article/240681-overview#a5
- http://www.mayoclinic.org/diseases-conditions/hypercalcemia/basics/causes/con-20031513
- http://www.uptodate.com/contents/image?imageKey=ENDO/66865&topicKey=ENDO%2F836&source=outline_link&utdPopup=true
- http://chemocare.com/chemotherapy/side-effects/hypocalcemia-low-calcium.aspx
Sód
ZAKRESY REFERENCYJNE DLA SODU W SUROWICY:
Laboratoryjny zakres referencyjny: 134-144 nmol/L
Optymalny zakres referencyjny: 135-140 nmol/L
OPIS:
Większość sodu (Na) w organizmie znajduje się w osoczu, gdzie jest głównym kationem pozakomórkowym. Sód odgrywa kluczową rolę w regulowaniu objętości płynu pozakomórkowego (ECF), ciśnienia krwi, równowagi osmotycznej i równowagi kwasowo-zasadowej, a także przyczynia się do spoczynkowego potencjału błonowego we wszystkich błonach komórkowych, co jest ważne dla funkcji mięśni i nerwów.[1],[2] Około 30% sodu znajduje się w niewymiennych miejscach, takich jak kości, ale stężenie sodu w surowicy jest użyteczną reprezentacją całkowitego sodu w organizmie.[3]
Sód nie może swobodnie dyfundować przez błony komórkowe, ale woda może. Gdy stężenie sodu w surowicy zmienia się, woda przemieszcza się do i z komórek, aby utrzymać równowagę osmotyczną między płynem wewnątrzkomórkowym i zewnątrzkomórkowym. Ze względu na to zjawisko, nieprawidłowe stężenie sodu w surowicy wskazuje przede wszystkim na zaburzenie równowagi wodnej (odwodnienie lub nadmierne nawodnienie), w przeciwieństwie do zaburzenia całkowitego stężenia sodu w osoczu. Te zmiany w bilansie wodnym nie powodują zaburzeń objętości ECF (hiperwolemii lub hipowolemii), dopóki stan nie jest ekstremalny, ponieważ około dwie trzecie wody jest wewnątrzkomórkowe, a tylko jedna trzecia jest zewnątrzkomórkowa.[4]
Homeostaza sodu w surowicy obejmuje nerki, jelita i podwzgórze. Jest ona utrzymywana głównie przez pragnienie i hormon antydiuretyczny (ADH, zwany także wazopresyną), które regulują odpowiednio spożycie wody i oszczędzanie wody w moczu.[4]
Wysokie stężenie sodu w surowicy (hipernatremia) jest zaburzeniem spowodowanym zbyt małą ilością wody lub odwodnieniem. Najczęściej jest ona spowodowana niezastąpioną utratą płynu, który jest hipotoniczny w stosunku do osocza; to znaczy utratą płynu, który ma stężenie osmotycznie aktywnych elektrolitów (tj. sodu i potasu), które jest niższe niż stężenie sodu w osoczu. Hipernatremia może być również spowodowana przeładowaniem sodem lub nadmiernym rozpadem glikogenu. Pełna lista konkretnych stanów, które mogą powodować wysokie stężenie sodu w surowicy, znajduje się poniżej. Spożycie wody koryguje hipernatremię, więc przedłużająca się hipernatremia wymaga albo upośledzonego pragnienia, co jest najczęściej spowodowane uszkodzeniami podwzgórza lub chorobą psychiczną, albo brakiem niezależnego dostępu do wody, co najczęściej występuje u niemowląt i osób starszych.[3]
Niskie stężenie sodu w surowicy (hiponatremia) to zaburzenie związane ze zbyt dużą ilością wody lub nadmiernym nawodnieniem. Może być spowodowane zaawansowaną niewydolnością nerek, niedożywieniem, pierwotną polidypsją (zwiększonym pragnieniem), zmniejszoną efektywną objętością krwi tętniczej, zespołem niewłaściwego wydzielania ADH (SIADH), niektórymi zaburzeniami endokrynologicznymi (niewydolność nadnerczy, niedoczynność tarczycy), ciążą, ekstremalnym wysiłkiem fizycznym, hiperglikemią, wchłanianiem roztworów irygacyjnych podczas operacji i wieloma lekami. Pseudohiponatremia może wystąpić, gdy frakcja wody w osoczu jest zmniejszona przez nienormalnie wysoką zawartość białka lub tłuszczu w surowicy. Hiponatremia jest nietypowa, jeśli zdolność do rozcieńczania moczu jest nienaruszona, ponieważ maksymalna osiągalna objętość moczu w normalnych warunkach wynosi ponad 10 l/dobę, podczas gdy normalne spożycie wody wynosi poniżej 2,5 l/dobę. Pełna lista zaburzeń, które mogą powodować hiponatremię, znajduje się poniżej.
WSKAZANIA ZAKRESU PATOLOGICZNEGO/KONWENCJONALNEGO:
Podwyższone poziomy:[3]
- Odwodnienie spowodowane niezastąpioną utratą płynu, który jest hipotoniczny w stosunku do osocza. Efekt jest przejściowy, chyba że pragnienie lub dostęp do wody są zahamowane.
– Utrata wody (niewyczuwalna, pot)
– Utrata wody z przewodu pokarmowego (wymioty, biegunka osmotyczna)
– Straty wody z moczem
– Centralna lub nefrogenna moczówka prosta
– Diureza osmotyczna spowodowana:
– Wysoki poziom glukozy (obserwowany w niekontrolowanej cukrzycy)
– mocznika (obserwowanego w przypadku wysokobiałkowego żywienia przez zgłębnik)
– Terapia mannitolem
– Uszkodzenia podwzgórza upośledzające pragnienie lub funkcję osmoreceptorów
– Moczówka prosta prosta
– Pierwotna hipodypsja
– Pierwotny nadmiar mineralokortykoidów
– Przeładowanie sodem (efekt jest przejściowy, chyba że pragnienie lub dostęp do wody są zahamowane)
– Przyjmowanie lub podawanie hipertonicznych roztworów sodu
– Zatrucie sodem
– Utrata wody do komórek w wyniku rozpadu glikogenu (efekt jest przejściowy)
– Ekstremalny wysiłek fizyczny
– Drgawki
– Leki
– Diuretyki pętlowe[4]
Obniżone poziomy:[5]
- Niskie spożycie substancji rozpuszczanych w diecie
– Potomstwo pijącego piwo
– Niedożywienie - Pierwotna polidypsja, z powodu:
– Niektóre choroby psychiczne
– Zmiany podwzgórza wpływające na centrum pragnienia (jak widać w sarkoidozie) - Zaawansowana niewydolność nerek
- ADH (hormon antydiuretyczny)
– Zmiany hormonalne
– Niewydolność nadnerczy
– Niedoczynność tarczycy
– Ciąża
– Ekstremalne ćwiczenia (np. maraton, ultramaraton, wędrówki po pustyni)
– Zmniejszona skuteczna objętość krwi tętniczej
– Rzeczywiste zmniejszenie objętości (wymioty, biegunka)
– Zmniejszona perfuzja tkanek (niewydolność serca, marskość)
Zespół niewłaściwego wydzielania ADH (SIADH), z powodu:6
– Jakiekolwiek zaburzenia ośrodkowego układu nerwowego (np. udar, krwotok, zakażenie, uraz)
– Ektopowe wytwarzanie ADH przez nowotwór (np. rak drobnokomórkowy, nerwiak węchowy, rak głowy i szyi)
– Zabiegi chirurgiczne
– Choroby płuc (np. zapalenie płuc, astma, niedodma, ostra niewydolność oddechowa, odma opłucnowa)
– Niedobór hormonów (np. niedoczynność przysadki)
– Egzogenna terapia hormonalna (np. wazopresyna, desmopresyna, oksytocyna)
– Objawowe zakażenie HIV
– Niektóre zaburzenia genetyczne
– Zespół nerczycowy niewłaściwej antydiurezy
– Polimorfizmy w genach kodujących osmoreceptor podwzgórza
– Ruch wody z komórek
– Hiperglikemia
– Leczenie mannitolowe
– Absorpcja roztworów irygacyjnych (glicyny, sorbitolu, mannitolu) podczas zabiegu chirurgicznego
– Pseudohiponatremia, spowodowana zmniejszeniem frakcji wodnej w osoczu (laboratoryjny artefakt)
– Hiperlipidemia
– Żółtaczka cholestatyczna i obturacyjna (lipoproteina X)
– Szpiczak mnogi
– Leki
-Tiazydowe leki moczopędne
– Niesteroidowe leki przeciwzapalne (aspiryna, ibuprofen, naproksen)
– Zatrucie ecstasy lub MDMA
– Opiaty (np. kodeina, morfina)
– Cyprofloksacyna
– Selektywne inhibitory wychwytu zwrotnego serotoniny (np. fluoksetyna, sertralina)
– Trójpierścieniowe leki przeciwdepresyjne (amitryptylina)
– Inhibitory monoaminooksydazy przeciwdepresyjne
– Niektóre leki przeciwpsychotyczne (np. karbamazepina, okskarbazepina, tiotyksen, tiorydazyna, haloperydol)
– Leki przeciwarytmiczne (lorcainid, amiodaron)
– Leki stosowane w chemioterapii (w dużych dawkach dożylnie cyklofosfamid, winkrystyna, winblastyna, winorelbina, cisplatyna, melfalan, ifosfamid, metotreksat, imatynib w dużych dawkach)
– Chlorpropamid
– Interferon alfa
– Interferon-gamma
– Walproinian sodu
– Bromokryptyna
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- dysglikemia czynnościowa (sprawdzić inne markery dysregulacji glikemii)
- Dysregulacja osi HPA (bardziej prawdopodobna hiperfunkcja)
- Choroba Cushinga
- Łagodne odwodnienie
Obniżone poziomy:
- Funkcjonalna dysglikemia
- Niedoczynność tarczycy
- Dysregulacja osi HPA (bardziej prawdopodobna hipofunkcja)
- Choroba Addisona lub niewydolność nadnerczy wywołana glukokortykoidami
Odnośniki:
- http://web.archive.org/web/20110823114818/http://nuinfo-proto4.northwestern.edu/nutrition/factsheets/sodium.pdf
- Campbell, Neil (1987). Biology. Benjamin/Cummings. p. 795. ISBN 0-8053-1840-2.
- http://www.uptodate.com/contents/etiology-and-evaluation-of-hypernatremia
- http://www.uptodate.com/contents/general-principles-of-disorders-of-water-balance-hyponatremia-and-hypernatremia-and-sodium-balance-hypovolemia-and-edema
- http://www.uptodate.com/contents/causes-of-hyponatremia-in-adults
- http://www.uptodate.com/contents/pathophysiology-and-etiology-of-the-syndrome-of-inappropriate-antidiuretic-hormone-secretion-siadh
Potas
REFERENCYJNE WARTOŚCI STĘŻENIA POTASU W SUROWICY:
Laboratoryjny zakres odniesienia: 3,5–5,2 nmol/L
Optymalny zakres odniesienia: 4,0–4,5 nmol/L
OPIS:
Potas (K) jest elektrolitem, który przyczynia się do potencjału błony spoczynkowej we wszystkich błonach komórkowych, która jest potrzebna do funkcjonowania nerwów, mięśni i serca.[1] Potas jest ważny dla kontroli ciśnienia krwi, motoryki przewodu pokarmowego, homeostazy kwasowo-zasadowej, metabolizmu glukozy, czynności nerek oraz równowagi płynów i elektrolitów.[2-4] Homeostaza potasu obejmuje jelita i nerki i jest regulowana przez aldosteron, który działa poprzez zwiększenie wydzielania potasu z moczem W przybliżeniu 98 procentów jonów potasu są wśrodku komórek; ten chemiczny gradient utrzymuje energochłonnymi pompami Na+/K+-ATPase, insulinowymi receptorami i beta-2-adrenergicznymi receptorami. Stężenie potasu w surowicy jest powszechnym testem służącym do oceny stanu potasu.[5],[6]
Wysokie stężenie potasu w surowicy (hiperkaliemia) występuje niezbyt często u pacjentów z prawidłowym wydalaniem potasu z moczem z powodu procesu zwanego adaptacją potasu: wraz ze zwiększeniem przyjmowanego potasu zwiększa się również stopień i skuteczność wydalania z moczem. Zmniejszone wydalanie potasu z moczem może być jednak spowodowane kilkoma schorzeniami i lekami wymienionymi poniżej. Zwiększone uwalnianie potasu z komórek może również powodować wysokie stężenie potasu w surowicy; w tych przypadkach hiperkaliemia zazwyczaj utrzymuje się tylko wtedy, gdy występuje również niewydolność nerek. Często wysoki poziom potasu wskazuje na pseudohiperkaliemię, a nie prawdziwą hiperkaliemię, ponieważ powtarzające się zaciskanie pięści lub urazy podczas pobierania krwi mogą powodować zwiększone uwalnianie potasu z komórek w pobliżu miejsca pobierania krwi.[1]
Często występuje małe stężenie potasu w surowicy (hipokaliemia). Może to być spowodowane nieodpowiednim spożyciem pokarmu, niektórymi lekami, dializą, plazmaferezą, zwiększonym dopływem potasu do komórek, zmniejszonym wydalaniem potasu z komórek i zwiększoną utratą moczu, przewodu pokarmowego lub potu. Konkretna lista warunków i leków, które powodują te stany znajduje się poniżej.[7]
PATOLOGICZNE/KONWENCJONALNE WSKAZANIA:
Podwyższone poziomy:[1]
- Zmniejszone wydalanie potasu z moczem
– Ostra i przewlekła choroba nerek
– Hipoaldosteronizm
– Zależna od napięcia nerkowa kwasica kanalikowa, obserwowana u:
– Niedrożność dróg moczowych
– Toczeń zapalenie nerek
– Choroba sierpowatokrwinkowa
– Amyloidoza nerkowa
– Skuteczne zmniejszenie objętości krwi tętniczej
– Rzeczywiste zmniejszenie objętości krwi
– Niewydolność serca
– Marskość
– Rzadkie przyczyny
– Rodzinny pseudohypoaldosteronizm typu 1
– Rodzinny pseudohypoaldosteronizm typu 2 (zespół Gordona)
– Ureterojejunostomia
– Zwiększone uwalnianie potasu z komórek, zwłaszcza w przypadku współistniejącej niewydolności nerek
– Pseudohyperkalemia: podwyższenie stężenia potasu w próbce z powodu komplikacji pobierania krwi
– Uraz mechaniczny
– Powtarzające się zaciskanie pięści
– U pacjentów z trombocytozą
– U pacjentów z przewlekłą białaczką limfocytową
– U pacjentów z rodzinną hiperkaliemią
– Post
– Kwasica metaboliczna
– Hiperglikemia
– Niedobór insuliny, zwłaszcza w niekontrolowanej cukrzycy
– Nasilenie katabolizmu tkankowego, obserwowane u:
– Zespół rozpadu guza
– Rabdomioliza
– Trauma
– Ciężka przypadkowa hipotermia
– Rzadkie przyczyny
– Rodzinny paraliż hiperkaliemiczny
– Przedawkowanie niektórych roślin (naparstnicy, pokrewne glikozydy naparstnicy)
– Transfuzja krwinek czerwonych, zwłaszcza u niemowląt z masywnymi transfuzjami
– Podawanie sukcynylocholiny u pacjentów z chorobami nerwowo-mięśniowymi, oparzeniami, ciężkim urazem, długotrwałym unieruchomieniem lub przewlekłym zakażeniem
– Podawanie chlorowodorku argininy
– Leki
– Niesteroidowe leki przeciwzapalne (aspiryna, ibuprofen, naproksen)
– Leki moczopędne oszczędzające potas (spironolakton, eplerenon, amiloryd, triamteren)
– Somatostatyna lub agonista somatostatyny (oktreotyd)
– Beta-blokery, zwłaszcza nieselektywne beta-blokery (np. propranolol, labetalol)
– Inhibitory enzymu konwertującego angiotensynę (ACE)
– Blokery receptora angiotensyny II (ARB)
– Kwas aminokapronowy
– Heparyna
– Aktywatory kanałów potasowych zależnych od ATP
– Inhibitory kalcyneuryny (np. cyklosporyna, takrolimus)
– Diazoksyd
– Minoksydyl
– Niektóre lotne środki znieczulające (np. izofluran)
Obniżone poziomy:[7]
- Nieodpowiednie spożycie pokarmu
- Dieta niskokaloryczna
- Zwiększone straty potu
- Dializa
- Plazmafereza
- Zwiększony dostęp potasu do komórek
– Zwiększona aktywność beta-adrenergiczna (np. z powodu dużego stresu)
– Zasadowica metaboliczna lub oddechowa
– Ostry wzrost produkcji krwinek
– Hipotermia
– Okresowy paraliż hipokaliemiczny - Zmniejszenie wydalania potasu z komórek
– Zatrucie barowe
– Zatrucie cezem - Zwiększona utrata potasu z przewodu pokarmowego
– Wymioty
– Przewlekła biegunka
– Nadużywanie środków przeczyszczających
– Spożycie gliny
– Zespół Ogilviego - Zwiększona utrata potasu z moczem
– Pierwotny nadmiar mineralokortykosteroidów (np. pierwotny aldosteronizm)
– Hipomagnezemia
– Nerkowa kwasica kanalikowa
– Poliuria
– Zespół Liddle’a
– Nefropatie wyniszczające sól
– Zespół Barttera
– Zespół Gitelmana
– choroby kanalikowo-śródmiąższowe (widoczne w zespole Sjögrena)
– Hiperkalcemia
– Uszkodzenie kanalików (jak widać w białaczce)
– Leki
– Leki moczopędne (zwłaszcza inhibitory anhydrazy węglanowej, diuretyki pętlowe, diuretyki tiazydowe)
– Amfoterycyna B
– Cisplatyna
– Chlorochina
– Niektóre leki przeciwpsychotyczne (rysperydon, kwetiapina)
– Teofilina
– Penicylina w dużych dawkach
– Agoniści receptorów beta-adrenergicznych
– Albuterol
– Terbutalina
– Dobutamina
– Sympatykomimetyki
– Pseudoefedryna
– Efedryna
– Heroina
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Funkcjonalna dysglikemia
- Dysfunkcja osi HPA
- Zaburzenia czynności nerek
- Pseudohipoaldosteronizm
Obniżone poziomy:
- Funkcjonalna dysglikemia
- Dysfunkcja osi HPA
- Złe wchłanianie i niedożywienie
- Alkoholizm
- Leki takie jak antybiotyki lub diuretyki
- Wiele innych stanów chorobowych
Odnośniki:
- http://www.uptodate.com/contents/causes-and-evaluation-of-hyperkalemia-in-adults
- ID, Linus S, Wingo CS. Disorders of potassium metabolism. In: Freehally J, Johnson RJ, Floege J, eds. Comprehensive clinical nephrology. 5th ed.St. Louis: Saunders, 2014:118-118
- Malnic G, Giebisch G, Muto S, Wang W, Bailey MA, Satlin LM. Regulation of K+ excretion. In: Alpern RJ, Caplan MJ, Moe OW, eds. Seldin and Giebisch’s the kidney: physiology and pathophysiology. 5th ed. London: Academic Press, 2013:1659-1716
- Mount DB, Zandi-Nejad K. Disorders of potassium balance. In: Taal MW, Chertow GM, Marsden PA, Skorecki KL, Yu ASL, Brenner BM, eds. The kidney. 9th ed. Philadelphia: Elsevier, 2012:640-688
- http://www.uptodate.com/contents/clinical-manifestations-of-hyperkalemia-in-adults
- http://www.uptodate.com/contents/clinical-manifestations-and-treatment-of-hypokalemia-in-adults
- http://www.uptodate.com/contents/causes-of-hypokalemia-in-adults
Chlorek w surowicy
ZAKRESY REFERENCYJNE DLA CHLORKÓW W SUROWICY:
Laboratoryjny zakres referencyjny: 97–108 mmol/L
Optymalny zakres referencyjny: 100–106 mmol/L
OPIS:
Chlorek jest jednym z głównych elektrolitów organizmu. Anion znajduje się w całym organizmie, chociaż krew zawiera szczególnie wysoki poziom. Procesy komórkowe utrzymują zewnątrzkomórkowe stężenia chloru wyższe niż wewnątrzkomórkowe.[1] W przypadku sodu chlorek utrzymuje ciśnienie osmotyczne i równowagę wodną oraz przyczynia się do osmolalności surowicy.[2],[3] Chlorek uczestniczy również w homeostazie kwasowo-zasadowej, działając jako bufor i utrzymując prawidłowy gradient elektryczny przez błony komórkowe.[3-5]
W diecie spożywane są znaczne ilości chlorków. Chlorek jest swobodnie wchłaniany przez jelita i swobodnie filtrowany przez nerki.[5] Podobnie jak sód, większość chlorków jest ponownie wchłaniana przez nerki.6 W związku z tym poziom chlorków we krwi zwykle porusza się w tym samym kierunku i proporcjonalnie do sodu.[4] Jednak w stanach patologicznych, takich jak zaburzenia kwasowo-zasadowe, poziomy chlorków mogą zmieniać się niezależnie od sodu.[4] Transportery wodorowęglanowo-chlorkowe i kanały chlorkowe w kanalikach nerkowych zmieniają poziom chlorków w surowicy w odpowiedzi na kwas. zakłócenia podstawowe.[6]
Hiperchloremia, czyli nienormalnie wysokie stężenie chlorków we krwi, może wystąpić w kilku stanach.[7] Hiperchloremia często występuje w przypadku hipernatremii, ale nie zawsze występuje współistniejące podwyższenie. Nadmierne spożycie (np. utonięcie w słonej wodzie) lub podanie chlorku sodu (np. hipertoniczny wlew soli fizjologicznej) może powodować hiperchloremię i hipernatremię, podobnie jak utrata wolnej wody lub odwodnienie hipotoniczne (np. moczówka prosta).[7] Sama hipernatremia może prowadzić do hiperchloremii. Hiperchloremia bez hipernatremii jest często spowodowana zaburzeniami kwasowo-zasadowymi, zwykle hiperchloremiczną kwasicą metaboliczną. Hiperchloremiczna kwasica metaboliczna ma wiele przyczyn, od wczesnej niewydolności nerek po ciężką biegunkę. Wiadomo, że różne leki, w tym inhibitory anhydrazy węglanowej, powodują hiperchloremiczną kwasicę metaboliczną.
Hipochloremia to nienormalnie małe stężenie chlorków w surowicy. Etiologia hipochloremii jest często pogrupowana w przyczyny nerkowe i pozanerkowe.[7] Utrata chlorku nerkowego może wystąpić w wyniku nadużywania leków moczopędnych, śródmiąższowego zapalenia nerek, przewlekłej niewydolności nerek i niewydolności nadnerczy. Pozanerkowe przyczyny hipochloremii mogą być spowodowane całkowitym niedoborem chlorków w organizmie, rozcieńczeniem i nieprawidłowościami kwasowo-zasadowymi. Chlorki mogą być wyczerpane przez niewystarczające spożycie lub nadmierne straty. Chlorek w surowicy jest rozcieńczany przez względny wzrost innych substancji, takich jak wolna woda. Rozcieńczające przyczyny hipochloremii obejmują stany takie jak nerczyca, zespół niewłaściwego hormonu antydiuretycznego (SIADH) i patologiczna polidypsja (nadmierne spożycie wody). Kwasica metaboliczna może powodować zmniejszenie stężenia chlorków w surowicy, podobnie jak kompensacja kwasicy oddechowej.
Stężenie chlorków w surowicy jest praktycznie zawsze mierzone wraz z innymi składnikami podstawowego panelu metabolicznego lub kompleksowego panelu metabolicznego.[8] Chlorek może być również mierzony w moczu lub na ramieniu, jako część testu potu chlorkowego.
WSKAZANIA PATOLOGICZNE/KONWENCJONALNE:
Podwyższone poziomy:[2],[10]
- Odwodnienie
- Choroba nerek
– Wczesna niewydolność nerek
– Śródmiąższowa choroba nerek
– Zespół nerczycowy
– Kwasica kanalików nerkowych - Zaburzenia kwasowo-zasadowe
– Kwasica metaboliczna
– Utrata wodorowęglanów (np. biegunka jelita cienkiego)
– Hipernatremia
– Zasadowica oddechowa - Schorzenia hormonalne
– Moczówki
– Niedobór mineralokortykoidów
– Nadczynność przytarczyc - Spożycie słonej wody
- Podawanie hipertonicznego roztworu soli fizjologicznej
- Leki
– Acetazolamid
– Chlorek amonu
– Androgenów
– Chlorowodorek argininy lub lizyny
– Zatrucie bromem
– Estrogeny
– Hydrochlorotiazydu
– Zatrucie jodem
– Zatrucie salicylanami
Obniżone poziomy:[2],[12]
- Niewystarczające spożycie NaCl
- Nieprawidłowości kwasowo-zasadowe
– Wyrównana kwasica oddechowa
– Zasadowica metaboliczna (np. wymioty, odsysanie nosowo-żołądkowe) - Schorzenia hormonalne
– Niewydolność nadnerczy
– Niedoczynność tarczycy
– Zespół niewłaściwego hormonu antydiuretycznego (SIADH) - Zastoinowa niewydolność serca
- Marskość wątroby
- Zespół nerczycowy
- Śródmiąższowe zapalenie nerek
- Przetoki jelita cienkiego
- Hiperglikemia (wczesna)
- Patologiczna polidypsja
- Leki
– Barbiturany
– Chlorpropamid
– Klofibrat
– Nadużywanie leków moczopędnych
– Morfina
– Nikotyna
– Trójpierścieniowe
WSKAZANIA ZAKRESU OPTYMALNEGO:
Podwyższone poziomy:
- Takie same jak wskazania konwencjonalne
Obniżone poziomy:
- Takie same jak wskazania konwencjonalne
Odnośniki:
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3118367/
- http://emedicine.medscape.com/article/2087713-overview#showall
- https://books.google.com/books?isbn=1285053133
- http://www.google.com/search?tbo=p&tbm=bks&q=isbn:0781730554
- https://labtestsonline.org/understanding/analytes/chloride/tab/sample/
- http://ajprenal.physiology.org/content/283/6/F1176
- http://www.ncbi.nlm.nih.gov/books/NBK309/
- https://labtestsonline.org/understanding/analytes/chloride/tab/test
- http://www.sciencedirect.com/science/article/pii/S021169951630025X
CO2 (dwutlenek węgla)
ZAKRESY REFERENCYJNE DLA CO2:
Laboratoryjny zakres odniesienia: 18–29 mmol/L
Optymalny zakres odniesienia: 25–30 mmol/L
OPIS:
Dwutlenek węgla (CO2) jest produktem ubocznym oddychania komórkowego, albo oddychania tlenowego lub fermentacji. Chemoreceptory w tętnicach szyjnych i aortalnych oraz na brzusznej bocznej powierzchni rdzenia przedłużonego wyczuwają dwutlenek węgla.[1] Względny poziom dwutlenku węgla wykrywany przez te chemoreceptory może wpływać na częstość oddychania.1 Cząsteczka blisko spokrewniona z dwutlenkiem węgla, wodorowęglan (HCO3), jest ważnym buforem we krwi. Mechanizmy fizjologiczne zmieniają pracę płuc i nerek, aby ściśle regulować pH krwi poprzez zmiany poziomu dwutlenku węgla i wodorowęglanów.[2]
Główny system buforowy we krwi zawiera wodorowęglan i kwas węglowy. Innymi słowy, na stężenie jonów wodorowych (pH) we krwi mogą wpływać zmiany poziomu krążących wodorowęglanów lub poziomu kwasu węglowego.[2] Kwas węglowy utrzymuje równowagę z dwutlenkiem węgla i wodą. Tak więc, wzrost lub spadek poziomu dwutlenku węgla, który może wystąpić poprzez odpowiednio zmniejszone lub zwiększone oddychanie, może powodować wzrost lub spadek poziomu kwasu węglowego. Kwas węglowy jest również przekształcany w jony wodorowęglanowe i hydronium. W nerkach i płucach enzym anhydrazy węglanowej katalizuje tę reakcję.[3]
Podwyższone ciśnienie cząstkowe dwutlenku węgla we krwi tętniczej nazywa się hiperkapnią. Podwyższone stężenie CO2 we krwi żylnej niekoniecznie oznacza hiperkapnię, ponieważ podwyższone stężenie CO2 w żyle może odpowiadać zasadowicy lub kwasicy. Wodorowęglan żylny jest miarą zastępczą CO2,2 Tak więc, podwyższony poziom wodorowęglanu we krwi sugeruje pewnego rodzaju zaburzenie kwasowo-zasadowe, albo zasadowicę metaboliczną lub kompensacyjną kwasicę oddechową.
Stężenie CO2 we krwi może być nienormalnie wysokie, gdy płuca nie mogą wydychać wystarczającej ilości dwutlenku węgla wytwarzanego przez tkankę czynną metabolicznie. Przykłady obejmują przewlekłą obturacyjną chorobę płuc (POChP) i surową astmę. Restrykcyjne choroby płuc, takie jak śródmiąższowa choroba płuc i sarkoidoza, mogą również powodować podwyższony poziom CO2. Rozległe wymioty są częstą przyczyną zasadowicy metabolicznej i towarzyszącego jej podwyższenia stężenia CO2 we krwi.
Nieprawidłowo niski poziom dwutlenku węgla we krwi żylnej może być spowodowany kwasicą metaboliczną lub zasadowicą układu oddechowego. Kwasica metaboliczna zazwyczaj wiąże się z problemami z nerkami, takimi jak nerkowa kwasica kanalikowa lub pewne zakwaszenie krwi, które może być spowodowane przez leki lub środki odurzające.[2] Głównym problemem zasadowicy dróg oddechowych jest hiperwentylacja, która może być związana ze stanem zdrowia medycznego lub psychicznego (np. zaburzenia lękowe, uogólnione zaburzenia lękowe).
CO2 mierzy się w krwi żylnej wraz z innymi składnikami podstawowego metabolicznego panelu lub kompletnego metabolicznego panelu. Nie jest możliwe dokładne zdiagnozowanie zaburzeń kwasowo-zasadowych na podstawie wyizolowanego pomiaru całkowitego CO2.[2] Zaburzenia kwasowo-zasadowe można określić, jeśli zna się pH, ciśnienie cząstkowe dwutlenku węgla (PaCO2), poziomy całkowitego CO2, sodu i chlorku.[2] Do określenia szczeliny anionowej stosuje się sód i chlorek. Przyczyny kwasicy są różne w zależności od tego, czy szczelina anionowa jest normalna, czy zwiększona.
PATOLOGICZNE/KONWENCJONALNE WSKAZANIA:
Podwyższone poziomy:[2],[4],[5]
- Obturacyjna choroba dróg oddechowych (np. POChP, ciężka astma)
- Choroba restrykcyjna dróg oddechowych (np. śródmiąższowa choroba płuc, sarkoidoza)
- Zasadowica metaboliczna
– Przewlekłe wymioty
– Zespół Conna
– Hiperaldosteronizm
– Zespół Cushinga
– Hipokaliemia
– Skurcz objętości
– Diuretyki
– Nadmierne spożycie lukrecji
Obniżone poziomy:[2],[4],[5]
- Zasadowica układu oddechowego (np. hiperwentylacja)
- Kwasica metaboliczna
– Niewydolność nerek
– Nerkowa kwasica kanalikowa (typ I, II, IV)
– Kwasica ketonowa
– Kwasica mleczanowa
– Przedłużająca się biegunka
– Choroba Addisona - Leki i toksyny
– Zatrucie glikolem etylenowym
– Zatrucie metanolem
– Zatrucie alkoholem
– Zatrucie salicylanami (np. przedawkowanie aspiryny)
– Paraldehyd
– Acetazolamid
WSKAZANIA ZAKRESU FUNKCJONALNEGO:
Podwyższone poziomy:
- Rozedma płuc
- Stosowanie moczopędne
- Aldosteronizm
- Nadmierne wymioty
Obniżone poziomy:
- Funkcjonalna dysglikemia (sprawdź inne markery dysglikemii)
- Stosowanie salicylanów i leków moczopędnych
- Post lub niedożywienie
Odnośniki:
- http://www.ncbi.nlm.nih.gov/pubmed/26335642
- http://www.ncbi.nlm.nih.gov/books/NBK308/
- http://www.ncbi.nlm.nih.gov/pubmed/22607884
- https://labtestsonline.org/understanding/analytes/blood-gases/tab/test/
- https://labtestsonline.org/understanding/analytes/co2/tab/test/
Źródło: https://www.jenngibbons.com/my-approach/functional-medicine/lab-markers
- Kompleksowy panel metaboliczny: interpretacja
- Kompletna morfologia krwi: interpretacja wyników badań
- To białko może sygnalizować przedwczesną śmierć
- Badania krwi w pakiecie sercowym pozwalające na wykrycie nieprawidłowości pracy serca i układu sercowo-naczyniowego
- Ogrom zalet oleju kokosowego popartych nauką
- Odkrywanie supermocy samouzdrawiania organizmu
- Czarny ryż bije brązowy, jeśli chodzi o korzyści zdrowotne
- Dlaczego jedzenie późnym wieczorem szkodzi zdrowiu
- Pułapki zdrowego odżywiania
- Regularna suplementacja witaminy C zapewnia ochronę układu sercowo-naczyniowego
- Niedobór witaminy D zwiększa ryzyko nieregularnego bicia serca
- Atak serca i choroba wieńcowa – publikacje naukowe